HELSINKIYFIRLÝSING ALÞJÓÐAFÉLAGS LÆKNA

UM SIÐFRÆÐILEGAR MEGINREGLUR FYRIR LÆKNISFRÆÐILEGAR RANNSÓKNIR Á MÖNNUM
Samþykktar á 18. heimsþingi lækna í Helsinki í júní 1964
INNGANGUR
1.
- Alþjóðafélag lækna (WMA) hefur þróað Helsinkiyfirlýsinguna sem greinargerð um siðfræðilegar meginreglur fyrir læknisfræðilegar rannsóknir á mönnum, þar með taldar rannsóknir á persónugreinanlegum gögnum og efnum úr mönnum.
- Ætlast er til að yfirlýsingin sé lesin í heild og að tillit sé tekið til allra annarra viðeigandi greina þegar einstökum greinum hennar er beitt.
2.
- Í samræmi við umboð WMA, er yfirlýsingunni fyrst og fremst beint til lækna.
- WMA hvetur aðra sem eiga hlut að læknisfræðilegum rannsóknum á mönnum, til að taka upp þessar meginreglur.
ALMENNAR MEGINREGLUR
3.
4.
- Það er skylda læknisins að efla og vernda heilsu, velferð og réttindi sjúklinga, —og það á einnig við um þá sem taka þátt í læknisfræðilegum rannsóknum.
- Þekking og samviska læknisins er helguð því að uppfylla þessa skyldu.
5.
- Framfarir í læknisfræði hvíla á rannsóknum, sem á endanum hljóta að fela í sér tilraunir á mönnum.
6.
- Aðal tilgangur læknisfræðilegra rannsókna á mönnum er að skilja orsakir, þróunarferli og áhrif sjúkdóma, sem og að bæta íhlutanir til forvarna, greiningar og lækninga, aðferðir, aðgerðir og meðhöndlanir.
- Stöðugt verður að meta með rannsóknum öryggi, virkni, not, aðgengi og gæði, jafnvel bestu sönnuðu íhlutunaraðferða.
7.
- Læknisfræðilegar rannsóknir eru háðar siðferðislegum viðmiðum, sem efla og tryggja virðingu fyrir öllum mannlegum þátttakendum, jafnframt því að vernda heilsu þeirra og réttindi.
8.
- Þrátt fyrir að aðaltilgangur læknisfræðilegra rannsókna sé að skapa nýja þekkingu, má þetta markmið;
ALDREI GANGA FYRIR RÉTTINDUM OG HAGSMUNUM SÉRHVERS ÞÁTTAKANDA .
9.
- Það er skylda lækna, sem eiga aðild að læknisfræðilegum rannsóknum, að standa vörð um líf, heilsu, reisn og óskert ástand þátttakendanna, sjálfsákvörðunarrétt þeirra og leynd og trúnað um persónulegar upplýsingar þeirra.
- Ábyrgð á verndun þátttakenda verður ávallt að hvíla á lækninum eða öðrum heilbrigðisstarfsmanni og aldrei á þátttakendum í rannsókninni, jafnvel þótt þeir hafi veitt samþykki sitt.
10.
- Læknar verða að taka tillit til þeirra siðferðislegu reglna og viðmiða, sem og þeirra laga og reglna, sem gilda um rannsóknirá mönnum í heimalandi þeirra, svo og þær alþjóðlegu kröfur og viðmið sem við eiga.
- Engar siðferðislegar kröfur eða lög og reglurí neinu landi eða á heimsvísu, mega draga úreða afnema neina þá verndun þátttakenda, sem sett er fram í yfirlýsingu þessari.
11.
Haga skal rannsóknum svo, að sem minnstar líkur séu á mögulegum umhverfisskaða.
12.
- Læknisfræðilegar rannsóknir á mönnum mega þeir einir gera, sem hafa viðeigandi siðfræðilega og vísindalega menntun, þjálfun og hæfni.
- Rannsóknir á sjúklingum eða heilbrigðum sjálfboðaliðum eru háðar því að umsjón annist hæfur læknir eða annar hæfur heilbrigðisstarfsmaður.
13.
- Hópum sem ekki er nægilega sinnt í rannsóknum ætti að tryggja viðeigandi aðgang að þátttöku í þeim.
14.
- Læknar sem sameina læknisfræðilega rannsókn og læknisfræðilega umönnun, ættu aðeins að leita þátttöku sjúklinga sinna í rannsókninni að því marki sem réttlætanlegt er af hugsanlegu gildi hennar fyrir forvarnir, greiningu eða lækningar og aðeins ef læknirinn hefur góðar ástæður til þess að trúa því að þátttaka í rannsókninni muni ekki hafa neikvæð áhrifá heilsu sjúklinganna sem taka þátt.
15.
- Tryggja verður viðeigandi bætur og meðhöndlun fyrir þátttakendur sem hlotið hafa skaða af þátttöku sinni í rannsókninni.
ÁHÆTTA, BYRÐAR OG ÁVINNINGUR
16.
- Í læknisstörfum og í læknisfræðilegum rannsóknum fela flestar íhlutanir í sér áhættu og byrðar.
- Læknisfræðilega rannsókn á mönnum má aðeins gera ef mikilvægi markmiðsins vegur þyngra en áhætta og byrði fyrir þátttakandann.
17.
- Undanfari allra læknisfræðilegra rannsókna á mönnum skal vera vandað mat á fyrirsjáanlegri áhættu og byrðum fyrir einstaklinga og hópa sem þátt eiga í rannsókninni, borið saman við fyrirsjáanlegan ávinning fyrir þátttakendur og aðra einstaklinga eða hópa, sem búa við það ástand sem verið er að rannsaka.
- Innleiða skal úrræði til að lágmarka áhættu.
- Rannsakandi skal stöðugt fylgjast með, meta og skrá áhættu.
18.
- Læknar mega ekki taka þátt í læknisfræðilegum rannsóknum á mönnum, nema þeir séu fullvissir um það, aðáhættan hafi verið nægilega vel metinog að hægt sé að hafa hemil á henni á fullnægjandi hátt.
- Þegar í ljós kemur að áhættan vegur þyngra en hugsanlegur ávinningur, eða þegar endanleg sönnun liggur fyrir um afgerandi niðurstöðu, verða læknar að meta hvort eigi að halda áfram, breyta rannsókninni eða stöðva hana þá þegar.
VARNARLAUS ÞÝÐI OG EINSTAKLINGAR
19.
Sumir hópar og einstaklingar standa sérstaklega illa að vígi og eiga frekar á hættu að fara halloka eða hljóta meiri skaða en aðrir….
Allir varnarlausir hópar og einstaklingar ættu að hljóta sérlega ígrundaða vernd.
20.
- Læknisfræðileg rannsókn með varnarlausan hóp er aðeins réttlætanleg ef rannsóknin svarar heilbrigðisþörfum eða forgangsáherslum þýðisins og ekki er hægt að framkvæma rannsóknina með hóp sem stendur betur að vígi.
- Að auki verður að mega ætla að hópurinn sem um ræðir muni hafa hag af þekkingunni, aðferðum eða íhlutunum sem hljótast af rannsókninni.
VÍSINDALEGAR KRÖFUR OG RANNSÓKNARÁÆTLANIR
21.
- Læknisfræðilegar rannsóknir á mönnum verða að samrýmast viðteknum vísindalegum meginreglum, hvíla á ítarlegri þekkingu á vísindaritumog á öðrum viðeigandi heimildum, vera byggðar á viðeigandi tilraunum á rannsóknarstofu og, þar sem við á, tilraunum á dýrum. Virða ber velferð dýra, sem notuð eru í rannsóknum.
22.
- Hönnun og framkvæmd hverrar rannsóknar á mönnum skal vera skilmerkilega útskýrð og sýnt fram á réttmæti hennar í rannsóknaráætlun.
- Í þeirri áætlun skal vera yfirlýsing um siðferðisleg álitaefni sem tengjast rannsókninni og þess skal getið hvernig fjallað hefur verið um meginreglurnar sem settar eru fram í þessari yfirlýsingu.
- Í áætlun skulu vera upplýsingar um fjármögnun og bakhjarla, tengsl við stofnanir, hugsanlega hagsmunaárekstra, hvaða hvata þátttakendum er boðið og upplýsingar um ráðstafanir til þess að meðhöndla og/eða bæta þátttakendum skaða sem verður af völdum þátttöku í rannsókninni.
- Í klínískum rannsóknum verður rannsóknaráætlun einnig að lýsa viðeigandi ráðstöfunum sem taka við eftir rannsóknina.
23.
- Rannsóknaráætlun skal senda til umfjöllunar, umsagnar, leiðbeininga og samþykktar í viðeigandi vísindasiðanefnd áður en rannsóknin hefst.
- Þessi nefnd skal vinna á gegnsæjan hátt, vera óháð rannsakanda og bakhjarli og vera laus við öll önnur óviðeigandi áhrif, og verður hún að hafa til að bera viðeigandi hæfni.
- Nefndin skal taka mið af lögum og reglum þess lands eða landa, þar sem rannsóknin á að fara fram, svo og af alþjóðlegum gildum og viðmiðum sem við eiga, en slík lög, reglur og gildi mega þó ekki draga úr eða afnema nein þau verndarákvæði fyrir þátttakendur í rannsókninni, sem sett eru fram í þessari yfirlýsingu.
- Nefndin skal hafa rétt til þess að fylgjast með yfirstandandi rannsóknum.
- Rannsakandinn verður að láta nefndinni í té upplýsingar til eftirlits, sérstaklega um öll alvarleg meintilvik.
- Engar breytingar má gera á rannsóknaráætlun án umfjöllunar og samþykkis nefndarinnar.
- Eftir að rannsókninni er lokið, skulu rannsóknaraðilar skila lokaskýrslu til nefndarinnar, þar sem teknar eru saman almenn útkoma og niðurstöður rannsóknarinnar.
24. Allar ráðstafanir skal gera til þess að vernda einkalíf þátttakendanna og varðveita trúnað um persónuupplýsingar þeirra.
25.
Þátttaka einstaklinga sem færir eru um að veita upplýst samþykki fyrir þátttöku í læknisfræðilegri rannsókn, skal vera af frjálsum vilja.
- Þótt viðeigandi geti verið að ráðgast við aðra í fjölskyldunni og forsvarsmenn samfélagsins, má ekki skrá neinn sem fær er um að veita upplýst samþykki til þátttöku í rannsókn, nema viðkomandi veiti samþykki sitt af frjálsum vilja.
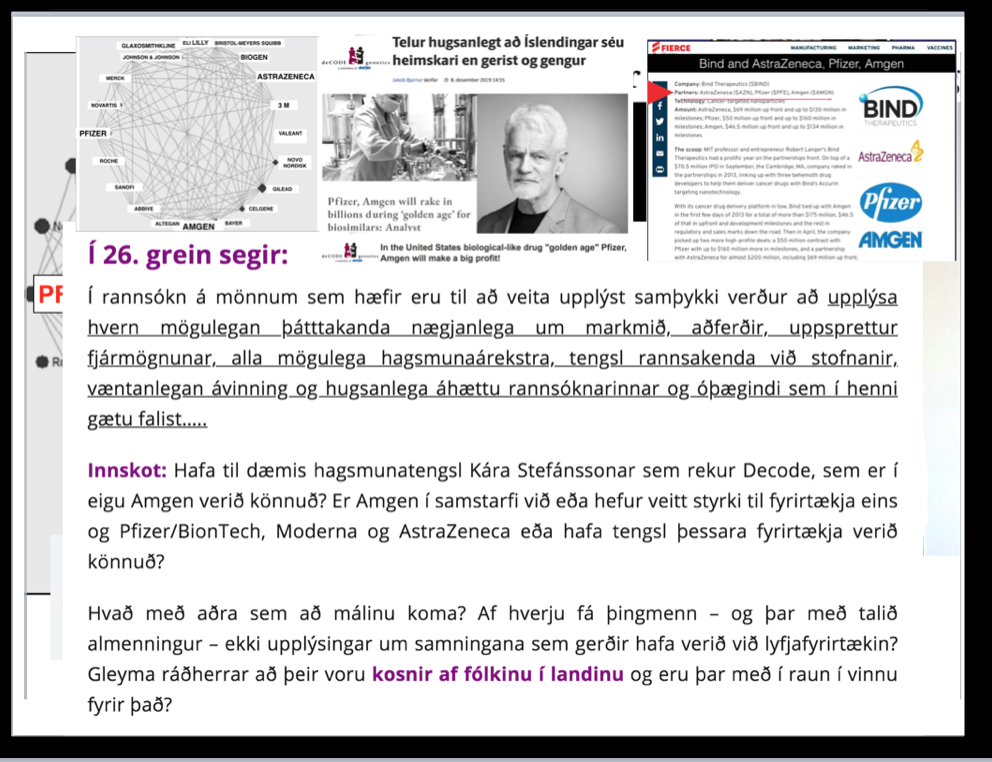
26.
Í rannsókn á mönnum sem hæfir eru til að veita upplýst samþykki verður að upplýsa hvern mögulegan þátttakanda nægjanlega um markmið, aðferðir, uppsprettur fjármögnunar, alla mögulega hagsmunaárekstra,tengsl rannsakanda við stofnanir, væntanlegan ávinning og hugsanlega áhættu rannsóknarinnar og óþægindi, sem í henni gætu falist, hvaða ráðstafanir eru ráðgerðar þegar rannsókn er lokið og öll önnur atriði varðandi rannsóknina sem gætu skipt máli.
- Mögulegan þátttakanda verður að upplýsa um réttinn til neita að taka þátt í rannsókninni eða að draga samþykki sitt til baka hvenær sem er, án eftirmála.
- Sérstaka athygli skal veita upplýsingaþörfum hvers og eins mögulegs þátttakanda, svo og því hvaða aðferðum er beitt til þess að koma upplýsingunum til skila.
- Eftir að hafa fullvissað sig um það, að mögulegur þátttakandi hafi skilið upplýsingarnar, skal læknirinn eða annar hæfur einstaklingur leita upplýsts samþykkis mögulega þátttakandans, sem veitt er af frjálsum vilja, helst skriflega. Ef ekki er unnt að afla skriflegs samþykkis, verður að skjalfesta og vottfesta formlega hið óskrifaða samþykki.
- Allir þátttakendur í rannsókn skulu eiga þess kost að fá upplýsingar um almenna útkomu og niðurstöður rannsóknarinnar.
27.
- Þegar leitað er upplýsts samþykkis fyrir þátttöku í rannsóknarverkefni, skal læknirinn vera sérlega varkár, ef mögulegur þátttakandinn er háður honum eða gæti veitt samþykki sitt nauðugur.
- Í slíkum tilvikum skal annar hæfur einstaklingur sem er algerlega óháður þessu sambandi leita upplýsts samþykkis.
28.
- Ef mögulegur þátttakandi í rannsókn er ekki fær um að veita upplýst samþykki, verður rannsakandinn að leita upplýsts samþykkis lögráðamanns.
- Slíka einstaklinga má ekki að taka inn sem þátttakendur ef engar líkur eru á að rannsóknin verði þeim sjálfum til ávinnings, nema því aðeins að rannsóknin sé ætluð til þess að efla heilbrigði þess hóps, sem mögulegur þátttakandi tilheyrir, að ekki sé í staðinn hægt að gera þessa rannsókn á einstaklingum sem færir eru um að veita upplýst samþykki og að rannsóknin feli aðeins í sér lágmarks áhættu og léttustu byrði.
29.
- Þegar mögulegur þátttakandi, sem telst ófær um að veita upplýst samþykki, er fær um að veita jáyrði sitt við ákvörðunum um þátttöku í rannsókn verður rannsakandinn að leita þess jáyrðis, auk samþykkis lögráðamannsins.
- Beri mögulegur þátttakandi fram andmæli skal virða þau.
30.
- Rannsókn á einstaklingum sem eru líkamlega eða andlega ófærir um að veita samþykki, svo sem meðvitundarlausum sjúklingum, má því aðeins gera, að það andlega eða líkamlega ástand sem kemur í veg fyrir að upplýsta samþykkisins sé veitt, sé nauðsynlegt sérkenni rannsóknarþýðisins.
- Við slíkar aðstæður skal læknirinn leita upplýsts samþykkis lögráðamanns.
- Sé enginn slíkur lögráðamaður tiltækur og þoli rannsóknin enga bið, má rannsóknin hefjast án upplýsts samþykkis, að því tilskildu, að þeim sértæku ástæðum fyrir því að þátttakendur í því ástandi, sem gerir þeim ókleift að veita upplýst samþykki, sé lýst í rannsóknaráætlun og að rannsóknin hafi verið samþykkt af vísindasiðanefnd.
- Samþykkis fyrir áframhaldandi þátttöku ætti að afla svo fljótt sem kostur er frá einstaklingnum eða lögráðamanni hans.
31.
- Læknirinn verður að upplýsa sjúklinginn um það að fullu, hvaða þáttur í umönnun hans tengist rannsókninni.
- Neiti sjúklingur að taka þátt í rannsókn eða ákveði að draga sig út úr henni, má það aldrei hafa neikvæð áhrif á samband sjúklings og læknis.
32.
- Fyrir læknisfræðilegar rannsóknir þar sem notaðar eru persónugreinanlegar upplýsingar eða efni úr mönnum, t.d. rannsóknir á efni eða upplýsingum úr lífsýnasafni eða svipuðum söfnum, verða læknar að leita upplýsts samþykkis fyrir söfnun, varðveislu og/eða endurnotkun þeirra.
- Þó geta einkar óvenjulegar aðstæður gert að verkum að ómögulegt eða illframkvæmanlegt er að afla samþykkis fyrir slíkri rannsókn.
- Við slíkar aðstæður má aðeins gera rannsóknina eftir umfjöllun og samþykki vísindasiðanefndar.
NOTKUN LYFLEYSU
33.
Ávinning, áhættu, byrðar og árangur af nýrri íhlutun verður að prófa á móti bestu sönnuðu íhlutun (eða íhlutunum), nema við eftirfarandi aðstæður
- Þar sem engin sönnuð íhlutun er til er leyfilegt að nota lyfleysu eða veita enga meðferð; eða
- ef ríkar og vísindalega traustar aðferðafræðilegar ástæður eru fyrir því, að til að ákvarða virkni eða öryggi íhlutunar sé nauðsynlegt er að nota einhverja árangursminni íhlutun en þá bestu sönnuðu, lyfleysu eða enga meðferð og sjúklingarnir, sem fá árangursminni íhlutun en þá bestu sönnuðu, lyfleysu eða enga íhlutun, eru ekki settir í aukna hættu á alvarlegum eða óafturkallanlegum skaða vegna þess að þeir fengu ekki bestu sönnuðu íhlutun.
- Ýtrustu varúðar verður að gæta til þess að koma í veg fyrir misnotkun þessa valkostar.
Ráðstafanir eftir rannsóknina
34.
- Áður en klínísk rannsókn hefst skulu bakhjarlar, rannsakendur og yfirvöld landsins þar sem rannsóknin fer fram gera ráðstafanir til þess að allir þeir þátttakendur, sem enn þarfnast íhlutunar að rannsókn lokinn, fái aðgang að gagnlegum íhlutunum, sem leiða af rannsókninni.
- Einnig skal upplýsa þátttakendur um þetta þegar upplýsts samþykkis er aflað.
Rannsóknaskráning, birting og dreifing niðurstaðna
35.
- Sérhverja rannsókn á mönnum skal skrá í gagnagrunn, sem er aðgengilegur almenningi, áður en öflun fyrsta þátttakandans á sér stað.
36.
Rannsakendur, höfundar, bakhjarlar, ritstjórar og útgefendur hafa allir siðferðislegum skyldum að gegna hvað varðar birtingu og dreifingu niðurstaðna rannsókna.
- Rannsakendum er skylt að birta opinberlega niðurstöður rannsókna sinna á mönnum og eru þeir ábyrgir fyrir að skýrslur þeirra séu tæmandi og nákvæmar.
- Allir aðilar eiga að fylgja viðurkenndum viðmiðum um siðferðislega skýrslugerð.
- Bæði neikvæðar niðurstöður, útkomu rannsókna sem skila ekki afgerandi niðurstöðu, jafnt og jákvæðar niðurstöður, skal birta á prenti eða þær gerðar almenningi aðgengilegar á annan hátt.
- Í útgefnu verki skal greina frá fjármögnun, tengslum við stofnanir og hagsmunaárekstrum.
- Skýrslur um tilraunir, sem ekki eru í samræmi við meginreglur þessarar yfirlýsingar, ætti ekki að taka til birtingar.
ÓSÖNNUÐ ÍHLUTUN Í KLÍNÍSKRI MEÐFERÐ
37.
- Hvað varðar læknismeðferð einstaks sjúklings, ef ekki eru til sannaðar íhlutanir eða aðrar þekktar íhlutanir hafa reynst árangurslausar, getur læknirinn, eftir að hafa leitað sérfræðilegrar ráðgjafar og að fengnu upplýstu samþykki sjúklings eða lögráðamanns hans, beitt ósannaðri íhlutun, ef hún gefur, að mati læknisins, vonir um að lífi sjúklingsins verði bjargað, að honum verði komið til heilsu á ný eða að þjáning verði linuð.
- Að því loknu ætti að taka þessa íhlutun fyrir í rannsókn, ætlaða til að meta öryggi hennar og virkni.
- Í öllum tilvikum skal skrá nýjar upplýsingar og birta þær opinberlega þar sem við á.
Um höfund

- ✞༺(((( Ⓒilla ℜągnąℜṧ )))༻♚༺ BA Classical Art Historian || MA Culture & Media || Tourism & Sales Management || Web Design || Photo & Videographer for Tourism Magasins ༻
Síðustu færslur
 MANNRÉTTINDI19. nóvember, 2024MENNTASPJALL VALGERÐAR SNÆLAND JÓNSDÓTTUR
MANNRÉTTINDI19. nóvember, 2024MENNTASPJALL VALGERÐAR SNÆLAND JÓNSDÓTTUR Sigurlaug Ragnarsdóttir15. ágúst, 2024‘Really Chilling’: Five Countries to Test European Vaccination Card
Sigurlaug Ragnarsdóttir15. ágúst, 2024‘Really Chilling’: Five Countries to Test European Vaccination Card MANNRÉTTINDI9. ágúst, 2024Lög um borgaralega handtöku voru felld úr gildi árið 2008
MANNRÉTTINDI9. ágúst, 2024Lög um borgaralega handtöku voru felld úr gildi árið 2008 MANNRÉTTINDI9. ágúst, 2024Með sameiginlegu átaki náum við að koma Sævar Kolandavelu í þessa lífsnauðsynlegu aðgerð á mánudaginn.
MANNRÉTTINDI9. ágúst, 2024Með sameiginlegu átaki náum við að koma Sævar Kolandavelu í þessa lífsnauðsynlegu aðgerð á mánudaginn.