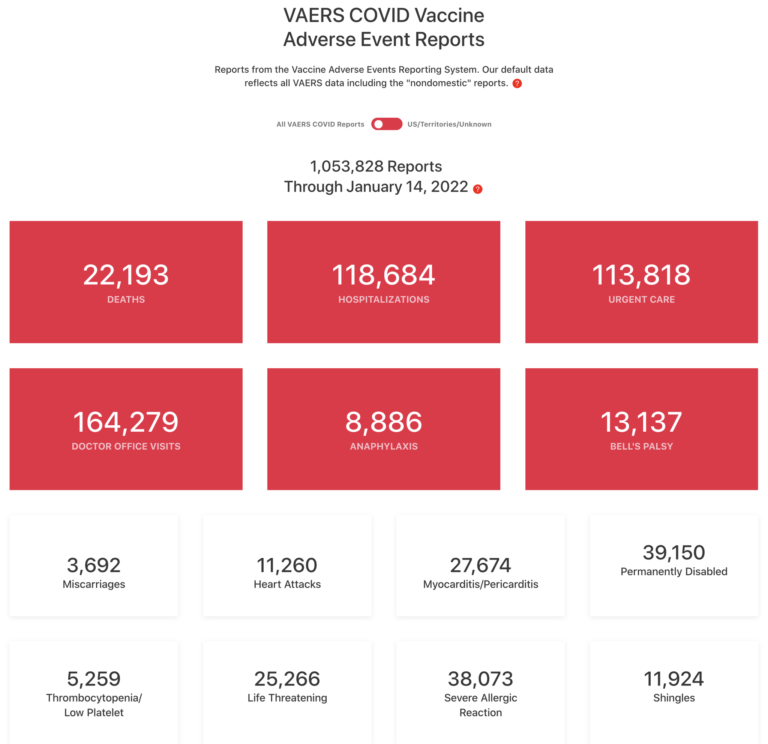
Klínísk lyfjarannsókn – Umsókn umklíníska lyfjarannsókn á mönnum þarf að fara fyrir Lyfjastofnun, Vísindasiðanefnd og Persónuvernd. Það þarf líka að að gefa upp sé aðalrannsakandi lyfjarannsóknarinnar er og hver sé ábyrgðaraðili sem er í þessu tilfelli Lyfjastofnun og þá undir eftirliti Landlæknis.
Þá á rannsóknin að vera aðgengileg almenningi á heimasíðu lyfjastofnunarinnar en það er hún ekki.

UPPLÝST SAMÞYKKI
25.
Þátttaka einstaklinga sem færir eru um að veita upplýst samþykki fyrir þátttöku í læknisfræðilegri rannsókn, skal vera af frjálsum vilja.
- Þótt viðeigandi geti verið að ráðgast við aðra í fjölskyldunni og forsvarsmenn samfélagsins, má ekki skrá neinn sem fær er um að veita upplýst samþykki til þátttöku í rannsókn, nema viðkomandi veiti samþykki sitt af frjálsum vilja.
https://gudrunbergmann.is/gengid-a-mannrettindin
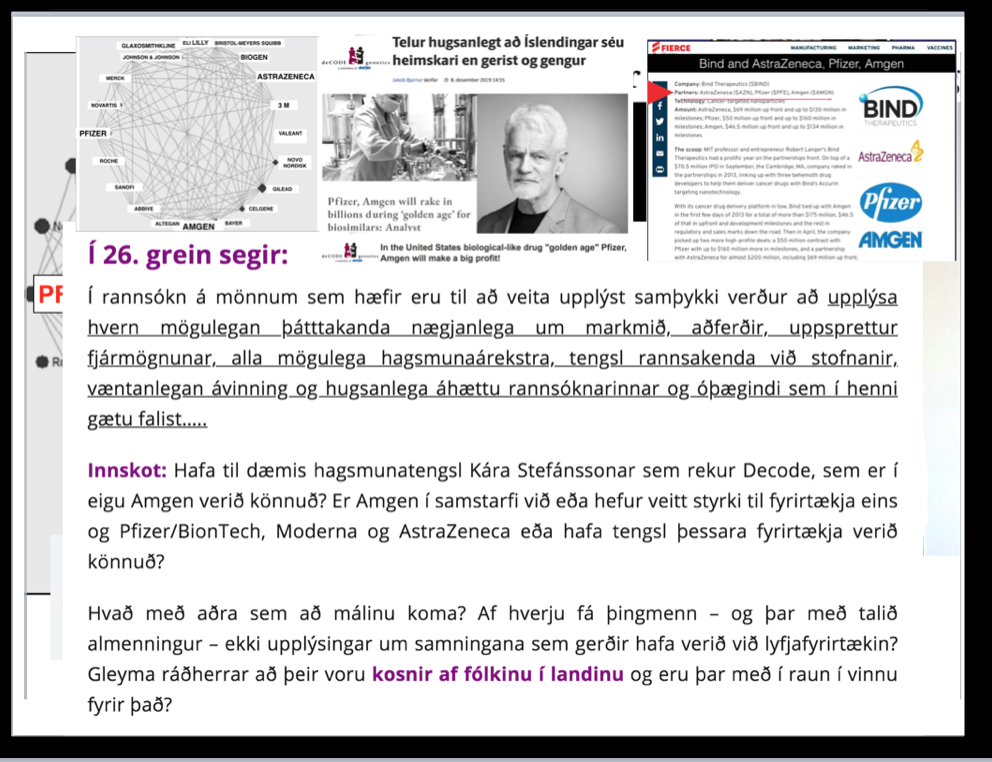
26.
Í rannsókn á mönnum sem hæfir eru til að veita upplýst samþykki verður að upplýsa hvern mögulegan þátttakanda nægjanlega um markmið, aðferðir, uppsprettur fjármögnunar, alla mögulega hagsmunaárekstra,tengsl rannsakanda við stofnanir, væntanlegan ávinning og hugsanlega áhættu rannsóknarinnar og óþægindi, sem í henni gætu falist, hvaða ráðstafanir eru ráðgerðar þegar rannsókn er lokið og öll önnur atriði varðandi rannsóknina sem gætu skipt máli.
- Mögulegan þátttakanda verður að upplýsa um réttinn til neita að taka þátt í rannsókninni eða að draga samþykki sitt til baka hvenær sem er, án eftirmála.
- Sérstaka athygli skal veita upplýsingaþörfum hvers og eins mögulegs þátttakanda, svo og því hvaða aðferðum er beitt til þess að koma upplýsingunum til skila.
- Eftir að hafa fullvissað sig um það, að mögulegur þátttakandi hafi skilið upplýsingarnar, skal læknirinn eða annar hæfur einstaklingur leita upplýsts samþykkis mögulega þátttakandans, sem veitt er af frjálsum vilja, helst skriflega. Ef ekki er unnt að afla skriflegs samþykkis, verður að skjalfesta og vottfesta formlega hið óskrifaða samþykki.
- Allir þátttakendur í rannsókn skulu eiga þess kost að fá upplýsingar um almenna útkomu og niðurstöður rannsóknarinnar.
27.
- Þegar leitað er upplýsts samþykkis fyrir þátttöku í rannsóknarverkefni, skal læknirinn vera sérlega varkár, ef mögulegur þátttakandinn er háður honum eða gæti veitt samþykki sitt nauðugur.
- Í slíkum tilvikum skal annar hæfur einstaklingur sem er algerlega óháður þessu sambandi leita upplýsts samþykkis.
28.
- Ef mögulegur þátttakandi í rannsókn er ekki fær um að veita upplýst samþykki, verður rannsakandinn að leita upplýsts samþykkis lögráðamanns.
- Slíka einstaklinga má ekki að taka inn sem þátttakendur ef engar líkur eru á að rannsóknin verði þeim sjálfum til ávinnings, nema því aðeins að rannsóknin sé ætluð til þess að efla heilbrigði þess hóps, sem mögulegur þátttakandi tilheyrir, að ekki sé í staðinn hægt að gera þessa rannsókn á einstaklingum sem færir eru um að veita upplýst samþykki og að rannsóknin feli aðeins í sér lágmarks áhættu og léttustu byrði.
29.
- Þegar mögulegur þátttakandi, sem telst ófær um að veita upplýst samþykki, er fær um að veita jáyrði sitt við ákvörðunum um þátttöku í rannsókn verður rannsakandinn að leita þess jáyrðis, auk samþykkis lögráðamannsins.
- Beri mögulegur þátttakandi fram andmæli skal virða þau.
30.
- Rannsókn á einstaklingum sem eru líkamlega eða andlega ófærir um að veita samþykki, svo sem meðvitundarlausum sjúklingum, má því aðeins gera, að það andlega eða líkamlega ástand sem kemur í veg fyrir að upplýsta samþykkisins sé veitt, sé nauðsynlegt sérkenni rannsóknarþýðisins.
- Við slíkar aðstæður skal læknirinn leita upplýsts samþykkis lögráðamanns.
- Sé enginn slíkur lögráðamaður tiltækur og þoli rannsóknin enga bið, má rannsóknin hefjast án upplýsts samþykkis, að því tilskildu, að þeim sértæku ástæðum fyrir því að þátttakendur í því ástandi,sem gerir þeim ókleift að veita upplýst samþykki, sé lýst í rannsóknaráætlun og að rannsóknin hafi verið samþykkt af vísindasiðanefnd.
- Samþykkis fyrir áframhaldandi þátttöku ætti að afla svo fljótt sem kostur er frá einstaklingnum eða lögráðamanni hans.
31.
- Læknirinn verður að upplýsa sjúklinginn um það að fullu, hvaða þáttur í umönnun hans tengist rannsókninni.
- Neiti sjúklingur að taka þátt í rannsókn eða ákveði að draga sig út úr henni, má það aldrei hafa neikvæð áhrif á samband sjúklings og læknis.
32.
- Fyrir læknisfræðilegar rannsóknir þar sem notaðar eru persónugreinanlegar upplýsingar eða efni úr mönnum, t.d. rannsóknir á efni eða upplýsingum úr lífsýnasafni eða svipuðum söfnum, verða læknar að leita upplýsts samþykkis fyrir söfnun, varðveislu og/eða endurnotkun þeirra.
- Þó geta einkar óvenjulegar aðstæður gert að verkum að ómögulegt eða illframkvæmanlegt er að afla samþykkis fyrir slíkri rannsókn.
- Við slíkar aðstæður má aðeins gera rannsóknina eftir umfjöllun og samþykki vísindasiðanefndar.

Umsókn um klíníska lyfjarannsókn
Bakhjarl (einstaklingur/fyrirtæki) þarf alltaf að sækja um leyfi til Lyfjastofnunar fyrir framkvæmd klínískrar lyfjarannsóknar. Aðalrannsakandi þarf alltaf að vera til staðar við framkvæmd klínískrar lyfjarannsóknar.Lyfjastofnun fer yfir gæði rannsóknarinnar og rannsóknarlyfsins ásamt að tryggja öryggi þátttakenda í klínískri lyfjarannsókn.Áður en klínísk lyfjarannsókn getur hafist þarf að vera búið að afla samþkkis frá Lyfjastofnun og Vísindasiðanefnd.Hafa skal í huga þegar sótt er um leyfi að:
- Reglugerðin nær ekki yfir rannsóknir án inngrips.
- Reglugerðin gildir fyrir aðgengis- og jafngildis rannsóknir (bioavailability og bioequivalence).
- Reglugerðin gildir fyrir geislavirk lyf, náttúrulyf, smáskammtalyf, lyf til genameðferðar eða lækninga með líkamsfrumum og lyf sem innihalda erfðabreyttar lífverur.
- Öll lyf (efni/vara) sem rannsaka á skulu vera framleidd samkvæmt leiðbeiningum um góða framleiðsluhætti (GMP).
Athuga þarf Helsinki-yfirlýsinguna frá 1996, um vernd einstaklinga sem ófærir eru um að veita löglegt samþykki, eftirlit með aukaverkunum o.fl.

Þá hefur Rúna Hvannberg þverneitað fyrir það, bæði í símtölum og tölvupósta samskiptum sl. 2 ár, að um klíníska lyfjarannsókn sé að ræða þótt að það standi skýrum stöfum á bls 15 – 104 í Pfizer Biontech bóluefnasamningum. Einnig í Pfizer Comirnaty innihaldslýsingunni á bls 50 – 67 og í Comirnaty áhættugreiningunni Risk Management Plan 2.0 frá 29. apríl 2021 frá Pfizer/BioNTech en voru aldrei kynntar fyrir almenningi.
KLÍNÍSKAR LYFJARANNSÓKNIR

I. KAFLI
- 1. gr. Gildissvið.
Þegar framkvæma á lyfjarannsóknir á mönnum er um tvennskonar rannsóknir að ræða;
- Vísindarannsókn á heilbrigðissviði sem Landlæknir ábyrgist og hefur eftirlit með.
- Klíníska rannsókn á heilbrigðissviði sem Lyfjastofnun ábyrgist og hefur eftirlit með.
Leita verður eftir upplýstu samþykki hjá þeim þáttakendum sem taka þátt í slíkum tilraunum eða rannsóknum, sama hvort er um vísinda eða klíníska rannsókn að ræða.
Vísindasiðanefnd hafði ekki borist umsókn fyrir PFIZER lyfjatilrauninni þann 7. febrúar árið 2021 eða rúmum 3 mánuðum eftir að byrjað var að sprauta fólk með tilraunaefnunum. (Desember, 2019)
Ný siðanefnd, sem sett var á laggirnar 2019, hefur ekki getað starfað sl. 2 ár. Kári Stefánsson varð æfur þegar að Katrín lagði frumvarpið fram og kallaði það fyrir Iinnihaldslaust þvaður þegar að nefndin var sett á laggirnar árið 2019.
-
SÓTTVARNARRÁÐ VAR ALDREI KALLAÐ SAMAN – EKKI EINU SINNI Í MIÐJUM HEIMSFARALDRI.
-
ÍSLENSK ERFÐAGREINING SAGÐI ALDREI FRÁ ÞEIRRI KLÍNÍSKU VÍSINDARANNSÓKN SEM FÓR FRAM Á BAKVIÐ TJÖLDIN VARÐANDI SKIMANIR ÁRIÐ 2020.
-
PERSÓNUVERND GERÐI ATHUGASEMD VIÐ ÓLÖGMÆTAR BLÓÐSÝNATÖKUR HJÁ ÍSLENSKRI ERFÐAGREININGU 2021.
Margt er á huldu um mögulega rannsókn

7. febrúar 2021
Vísindasiðanefnd hefur ekki borist umsókn: Um hvernig rannsókn verður að ræða?
Vísindasiðanefnd hefur ekki borist umsókn vegna mögulegrar rannsóknar Pfizer á bólusetningu íslensku þjóðarinnar sem nú er í skoðun. Ef erindi berst þarf hins vegar ekki að taka svo langan tíma að afgreiða það, segir formaður nefndarinnar. Sunna Snædal Jónsdóttir, sérfræðilæknir og formaður Vísindasiðanefndar, staðfesti í samtali við Vísi í gær að ef mögulegur samningur við Pfizer snúist um að bólusetja þjóðina í rannsóknarskyni muni koma til kasta nefndarinnar.
Hún fundar á tveggja vikna fresti, næst 16. febrúar, en að sögn Sunnu er mögulegt að boða til aukafundar í sérstökum tilvikum. Afgreiðsluhraðinn veltur á því hversu góðar upplýsingar fylgja umsókninni en oft á tíðum sendir nefndin umsækjendum athugasemdabréf með óskum um frekari upplýsingar.
- „Það þurfa að liggja fyrir ákveðin gögn og þetta fer mikið eftir því hvort allt liggur fyrir,“ svarar Sunna spurð um málshraðann.
Nokkrir aðilar þurfa að veita samþykki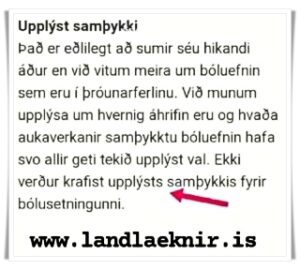
Vísindarannsóknir af þessu tagi geta verið tvenns konar; annars vegar rannsókn þar sem verið er að skoða gögn sem liggja fyrir og hins vegar rannsókn þar sem fólk er kallað inn til þátttöku og þarf að veita upplýst samþykki.
Í þeim tilvikum er að sögn Sunnu afar mikilvægt að fyrir liggi til hvers er verið að ætlast af fólki og hvaða upplýsingum eigi að safna. Útfærsla á þessu þarf að liggja fyrir þegar umsókn er send Vísindasiðanefnd. Jafnvel þótt málshraðinn hjá nefndinni geti verið hraður segir það þó ekki alla söguna, þar sem möguleg rannsókn Pfizer snýr að bólusetningu og kann að flokkast sem lyfjarannsókn. Slíkar rannsóknir þarf einnig að bera undir Lyfjastofnun og Persónuvernd.
Um hvernig rannsókn er verið að ræða og hver verða skilyrðin?
Það liggur hins vegar ekki fyrir nákvæmlega hvernig umrædd rannsókn myndi flokkast. Fátt hefur verið um svör á meðan viðræður hafa staðið yfir. Til dæmis ber að hafa í huga að verið er að tala um að rannsaka áhrif bólusetninga á þjóðina í heild og þannig væri rannsóknin ólík hefðbundnum lyfjarannsóknum að því leyti að ekki er verið að fylgjast með hverjum og einum þátttakanda fyrir sig.
- Hins vegar má líka sjá fyrir sér að Pfizer muni fara fram á að fá nánari upplýsingar um einhverja þátttakendur, til dæmis þá sem kunna að greinast með Covid-19 þrátt fyrir að hafa verið bólusettir og þá þyrfti rannsóknin að uppfylla strangari skilyrði. Annað sem hefur ekki komið til umræðu er hvort Pfizer mun setja einhverja aðra skilmála í tengslum við rannsóknina. Það má til dæmis ímynda sér að fyrirtækið gæti krafist þess að öllum sóttvarnaaðgerðum yrði aflétt og landamærin opnuð gegn því að bólusetja þjóðina.
PFIZER BIONTECH BÓLUEFNA SAMNINGURINN ➡️ – Allt sem þú þarft að vita um leynilegu Pfizer lyfjatilraunina sem er framkvæmd án vitundar íslensku þjóðarinnar
- Hinn leynilegi EU & Pfizer bóluefnasamningur var samþykktur án samráðs við þá sitjandi alþingismenn, þeir voru aldrei beðnir um álit né samþykkt fyrir samningnum, eins og íslensk lög gera ráð fyrir.

- Þar sem líkurnar á misheppnuðu bóluefni eru mjög miklar þá verður íslenska ríkisstjórnin að leyna bóluefnatilrauninni fyrir íslensku þjóðinni. (Bls. 54)

NÜRNBERG KÓÐINN
HEIMASÍÐA LYFJASTOFNUNAR
- Klínískar lyfjarannsóknir
- Það þarf alltaf að sækja um leyfi til Lyfjastofnunar fyrir framkvæmd klínískrar lyfjarannsóknar. … Aðalrannsakandi þarf alltaf að vera til staðar við framkvæmd klínískrar lyfjarannsóknar.
- Klínískar prófanir
- Klínískar prófanir Lögum samkvæmt skal framleiðandi lækningatækis senda Lyfjastofnun umsókn um klíníska … Lyfjastofnun getur stöðvað framkvæmd klínískrar rannsóknar sé skilmálum ekki fylgt.
- Leiðbeiningar vegna klínískrar
- Leiðbeiningar vegna klínískrar prófunar á lækningatækjum 20. ágúst 2018 Birtar hafa verið leiðbeiningar … Sjá nánar: leiðbeiningar og eyðublað fyrir tilkynningar vegna klínískrar prófunar Prenta síðu Var efnið
- Klínískar lyfjarannsóknir á tímum COVID-19 – leiðbeiningar
- Klínískar lyfjarannsóknir á tímum COVID-19 – leiðbeiningar 11. maí 2020 Framkvæmdastjórn Evrópusambandsins … hefur birt nýjar leiðbeiningar til að tryggja að klínískar lyfjarannsóknir geti haldið áfram á evrópska
- Ákall um samræmdar klínískar rannóknir vegna
- Ákall um samræmdar klínískar rannóknir vegna COVID-19 20. mars 2020 Sérfræðinganefnd Lyfjastofnunar Evrópu … er nú þegar í sambandi við ýmsa hagsmunaaðila sem lagt gætu lið varðandi framkvæmd slíkra samræmdra klínískra
- Veitt leyfi fyrir klínískar rannsóknir
- Veitt leyfi fyrir klínískar rannsóknir Samþykktar klínískar lyfjarannsóknir má finna í gagnagrunni Lyfjastofnunar … Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR
- Laus störf hjá Lyfjastofnun: Teymisstjóri í teymi klínískra rannsókna, sérfræðingur í teymi klínískra rannsókna og sérfræðingar í gæðamatsteymi
- Laus störf hjá Lyfjastofnun: Teymisstjóri í teymi klínískra rannsókna, sérfræðingur í teymi klínískra … rannsókna, sérfræðing í teymi klínískra rannsókna og sérfræðinga í gæðamatsteymi.
- Umsókn um klíníska lyfjarannsókn
- Umsókn um klíníska lyfjarannsókn Sækja þarf um leyfi til framkvæmdar klínískrar lyfjarannsóknar til Lyfjastofnunar … Nánari upplýsingar um þau gögn sem þurfa að fylgja umsókn til Lyfjastofnunar um leyfi til klínískrar
- 04. Hvernig er sótt um leyfi til framkvæmdar á klínískri rannsókn lækningatækis?
- Hvernig er sótt um leyfi til framkvæmdar á klínískri rannsókn lækningatækis? a. … Enn er sótt um leyfi til klínískrar rannsóknar á lækningatæki samkvæmt gildandi eyðublaði á heimasíðu
- 04. Hvernig er sótt um leyfi til framkvæmdar á klínískri rannsókn lækningatækis? Hvernig er sótt um leyfi til framkvæmdar á klínískri rannsókn lækningatækis? a. … Enn er sótt um leyfi til klínískrar rannsóknar á lækningatæki samkvæmt gildandi eyðublaði á heimasíðu
08. Hverjar eru tímalínur vegna klínískra rannsókna lækningatækja? Hverjar eru tímalínur vegna klínískra rannsókna lækningatækja? - 05. Hvað kostar að sækja um klíníska rannsókn?
Hvað kostar að sækja um klíníska rannsókn? … Gjald fyrir klíníska rannsókn er samkvæmt gjaldskrá Lyfjastofnunar.
- Móttaka umsókna um leyfi til klínískra lyfjarannsókna sumarið 2017
Móttaka umsókna um leyfi til klínískra lyfjarannsókna sumarið 2017 2. febrúar 2017 Vegna sumarfría mun … Lyfjastofnun hvetur umsækjendur til að miða áætlanir sínar vegna umsókna um leyfi fyrir klínískar lyfjarannsóknir
- Upptaka frá upplýsingafundi um nýja reglugerð klínískra prófana á mannalyfjum
Upptaka frá upplýsingafundi um nýja reglugerð klínískra prófana á mannalyfjum Fjallað var um breytingar … á gildandi reglugerð um klínískar prófanir á mannalyfjum á fundinum. 18. janúar 2022 Fimmtudaginn 13
- Upplýsingafundur um nýja reglugerð klínískra prófana á mannalyfjum 13. janúar nk.
Clinical Trial Information System / CTIS). 8. janúar 2022 Ný reglugerð um klínískar prófanir á mannalyfjum … umsýslu umsókna um nýjar rannsóknir og breytingar á rannsóknum og er í samræmi við regluverk ESB fyrir klínískar
- 07. Á að tilkynna um atvik sem gerast við klíníska rannsókn?
Á að tilkynna um atvik sem gerast við klíníska rannsókn?
- Síðasti dagur til að senda inn umsókn um klíníska lyfjarannsókn á árinu
desember 2017 Berist umsóknir um leyfi til klínískra lyfjarannsókna og breytinga á rannsóknaráætlun eftir … Lyfjastofnun hvetur umsækjendur til að miða áætlanir sínar vegna umsókna um leyfi fyrir klínískar rannsóknir
- Klínískt svið
Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR … Veitt leyfi fyrir klínískar rannsóknir Lyfjagát Aukaverkanir lyfja Aukaverkanatilkynningar vegna lyfjanotkunar
- kliniskar-profanir-a-laekningataekjum-leidb-lst-11-07-2018-2.pdf
Klínískt mat getur byggt á gögnum sem aflað er með klínískri prófun og/eða á fyrirliggjandi klínískum … klínískt mat geti byggt á fyrirliggjandi klínískum gögnum.
- Abacavir_DHPC_juni_2019.pdf
Klínísk greining ofnæmisviðbragða vegna abacavírs er áfram grundvöllur klínískrar ákvarðanatöku. … Ofnæmistilfelli Í fræðsluefninu eru 3 tilviksrannsóknarlíkön til að sýna mismunandi klínískar aðstæður
- ctis-kynning-hk-20220113.pdf
réttindi, öryggi, velsæld og hagsmunir þátttakenda gangi framar öllum öðrum hagsmunum við framkvæmd klínískrar … aðildarríkja EES og framkvæmdastjórnar Evrópusambandsins verður hægt að meta og hafa eftirlit með klínískum
- b-nr-1452-2020.pdf
Klínískar prófanir á lækningatækjum. … Klínískar prófanir á lækningatækjum. 4. gr.
- COVID-19 Vaccine Janssen (Janssen)
Niðurstöður klínískrar rannsóknar á bóluefninu leiddu í ljós að bóluefnið veitir vörn gegn COVID-19 hjá … Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR
- tilkynningaeydublad-um-kl-pr-a-laekningataeki-11-7-2018.docx
Útg. 06/2018 Tilkynningareyðublað Klínískar prófanir á lækningatækjum Þetta eyðublað er ætlað fyrir … tilkynningu um framkvæmd klínískrar prófunar á lækningatæki sem ekki hafa verið CE-merkt og lækningatæki
- Tilkynningar og skýrslur
Fyrir klínískar lyfjarannsóknir sem lauk fyrir 21. júlí 2014 skal bakhjarl birta niðurstöður afturvirkt … Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR
- b-nr-1451-2020.pdf
Klínískar lyfjarannsóknir og rannsóknir á aðgengi lyfja. … Klínískar lyfjarannsóknir og rannsóknir á aðgengi lyfja. III.
- birting-nidurstadna-i-eudract-is-3.doc
í EudraCT gagnagrunninn (https://eudract.ema.europa.eu/): Bakhjarl skal birta niðurstöður úr öllum klínískum … Fyrir klínískar lyfjarannsóknir sem lauk fyrir 21. júlí 2014 skal bakhjarl birta niðurstöður afturvirkt
- birting-nidurstadna-i-eudract-is.doc
í EudraCT gagnagrunninn (https://eudract.ema.europa.eu/): Bakhjarl skal birta niðurstöður úr öllum klínískum … Fyrir klínískar lyfjarannsóknir sem lauk fyrir 21. júlí 2014 skal bakhjarl birta niðurstöður afturvirkt
- B_nr_1160_2018.pdf
Klínískar lyfjarannsóknir og rannsóknir á aðgengi lyfja. … Klínískar lyfjarannsóknir og rannsóknir á aðgengi lyfja. III.
- COVID-19: Klórókín og
Stórar klínískar rannsóknir á lyfjunum eru í gangi og munu þær vonandi skila nauðsynlegum upplýsingum … Séu lyfin notuð við COVID-19 utan klínískra rannsókna ætti að fylgja stöðluðu verklagi í hverju landi
- Vaxzevria (AstraZeneca)
Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR … Veitt leyfi fyrir klínískar rannsóknir Lyfjagát Aukaverkanir lyfja Aukaverkanatilkynningar vegna lyfjanotkunar
- OVID-19: Lyfjastofnun Evrópu mælir með skilyrtu markaðsleyfi fyrir bóluefnið Nuvaxovid
- Niðurstöður klínískra rannsókna Niðurstöður tveggja klínískra rannsókna með yfir 45.000 þátttakendur … Aukaverkanir bóluefnisins Þær aukaverkanir sem komu fram við klínískar rannsóknir bóluefnsins voru yfirleitt
- Hagsmunaadilafundur-Lyfjastofnunar-um-laekningataeki-11.02.2020-Loka-utgafa-til-birtingar.pdf
- , › Einkvæma tækjaauðkenningu, › Skráningu rekstraraðila, › Tilkynnta aðila og fyrir vottorð, › Klínískar … MDR – 10. gr., 15. gr. og 52.gr. 17 Klínískar rannsóknir » Framleiðanda er skylt að: › Framkvæma
- xarelto-dhpc-oktober_2018.pdf
- hjá sjúklingum eftir ósæðarlokuskipti með þræðingu (transcatheter aortic valve replacement, TAVR) í klínískri … slembiröðuð, opin, fjölsetra III. stigs rannsókn með samanburði við virkt lyf, sem gerð var til að meta klínískan
- Xarelto-DHPC-oktober_2018.pdf
- hjá sjúklingum eftir ósæðarlokuskipti með þræðingu (transcatheter aortic valve replacement, TAVR) í klínískri … slembiröðuð, opin, fjölsetra III. stigs rannsókn með samanburði við virkt lyf, sem gerð var til að meta klínískan
- Hvatning vegna
- Þar með sé hægt að veita öllum aðgang að niðurstöðunum í hinni miðlægu, samevrópsku skrá um klínískar … Niðurstöður vantar fyrir ríflega fjórðung rannsókna Í apríl sl. var upplýsingar um 57.687 klínískar rannsóknir
- lst-greidsluthatttokuumsokn-2021.xls
- of Product Characteristics) 86 Yfirlit yfir greiðsluþátttöku í öðrum löndum innan EES. 83 Klínískur … Ef áhrif lyfsins eru ekki staðfest á klínískan hátt.
- Bóluefni gegn COVID-19
- Klínískar rannsóknir í þremur stigum (fösum): 1. stigs rannsóknir: Fyrstu skammtar bóluefnis eru yfirleitt … Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR
- SUSAR tilkynningar
- Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR … Veitt leyfi fyrir klínískar rannsóknir Lyfjagát Aukaverkanir lyfja Aukaverkanatilkynningar vegna lyfjanotkunar
- Spurt og svarað
- Þessir mælikvarðar fyrir virkni eru kallaðir “klínískir endapunktar”. … Ef svarið er já við einhverri ofangreindra fjögurra spurninga, fellur rannsóknin undir skilgreiningu klínískrar
- Bóluefni gegn COVID-19
- Klínískar rannsóknir í þremur stigum (fösum): 1. stigs rannsóknir: Fyrstu skammtar bóluefnis eru yfirleitt … Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR
- 170825-is-dhpc-haldol-haldol-dec-art-30_final_cleanannexes.pdf
- Hámarksskammtur er 20 mg/sólarhring því áhyggjur af öryggi vega þyngra en klínískur ávinningur … Hámarksskammtur er 15 mg/sólarhring því áhyggjur af öryggi vega þyngra en klínískur ávinningur
- 170825-IS—DHPC-Haldol–Haldol-Dec-art-30_final_clean annexes.pdf
- Hámarksskammtur er 20 mg/sólarhring því áhyggjur af öryggi vega þyngra en klínískur ávinningur … Hámarksskammtur er 15 mg/sólarhring því áhyggjur af öryggi vega þyngra en klínískur ávinningur
- CTFG / VHP
- Einnig er samvinna við undirbúning á innleiðslu nýju reglugerðarinnar um klínískar lyfjarannsóknir í … VHP (Voluntary Harmonisation Procedure) fyrir fjölþjóðlegar umsóknir um klínískar lyfjarannsóknir.
- Afgreiðslutími sumarið 2021
- Eftirfarandi takmarkanir verða á þjónustu Lyfjastofnunar í sumar: Klínískar lyfjarannsóknir Vegna sumarleyfa … Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR
- COVID-19 Vaccine Moderna (Moderna)
- Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR … Veitt leyfi fyrir klínískar rannsóknir Lyfjagát Aukaverkanir lyfja Aukaverkanatilkynningar vegna lyfjanotkunar
- Spikevax (Moderna)
- Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR … Veitt leyfi fyrir klínískar rannsóknir Lyfjagát Aukaverkanir lyfja Aukaverkanatilkynningar vegna lyfjanotkunar
- Spikevax (Moderna)
- Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR … Veitt leyfi fyrir klínískar rannsóknir Lyfjagát Aukaverkanir lyfja Aukaverkanatilkynningar vegna lyfjanotkunar
- Um stofnunina
- Áður en nýtt lyf kemst á markað eru framkvæmdar viðamiklar eiturefna-, gæða- og klínískar rannsóknir … Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR
- Evrópskur gagnabanki
Gagnabankinn mun einnig innihalda upplýsingar um klínískar rannsóknir lækningatækja, notendum til upplýsinga … Förgun lyfja Gæðastaðlar Innflutningur einstaklinga á lyfjum Klínískar lyfjarannsóknir CTFG / VHP SUSAR
- ecansya_xeloda_fluorouracil_accord_dhpc_juni_2020.pdf
- cansya_Xeloda_Fluorouracil_Accord_DHPC_juni_2020.pdf
lst-eydublad-umsokn-um-greidsluthatttoku-i-leyfisskyldum-lyfjum.docx
Af þróun lyfja og bóluefnis við COVID-19
bref-ti-heilbrigdisstarfsmanna-ivabradine-12-6-14.pdf
Bóluefni gegn COVID-19
Sex bóluefnum gegn COVID-19 hefur verið veitt markaðsleyfi á Íslandi. Ekkert bóluefni er í umsóknarferli og þrjú önnur bóluefni eru í flýtimati (áfangamati) hjá Lyfjastofnun Evrópu.
Bóluefni sem hafa hlotið markaðsleyfi á Íslandi
Comirnaty frá BioNTech og PfizerSpikevax frá ModernaVaxzevria frá AstraZenecaCOVID-19 Vaccine JanssenNuvaxovid frá NovavaxValneva
Bóluefni sem eru í umsóknarferli hjá Lyfjastofnun Evrópu
Bóluefni sem eru í flýtimati (áfangamati) hjá Lyfjastofnun Evrópu
Virkni bóluefna
Virkni allra bóluefna byggist á því að þau ræsa ónæmiskerfið þannig að það nái síðar meir að verja líkamann gegn ákveðnum sjúkdómi með því að þekkja þá sýklana sem honum valda.
Flestar rannsóknir á bóluefnum gegn COVID-19 hafa það að markmiði að líkaminn nái að mynda mótefnasvar við próteini sem er einstakt fyrir veiruna sem veldur sjúkdómnum (gaddaprótein (e. spike protein), eða hluta þess. Hjá þeim sem eru bólusettir og komast í návígi við veiruna bregst ónæmiskerfið því strax við og kemur í veg fyrir sýkingu eða veikindi.
Sömu ríku kröfur gerðar til bóluefna gegn COVID-19 og annarra lyfja
Um bóluefni gegn COVID-19 gilda sömu lagalegu kröfur og um önnur lyf hvað varðar gæði, öryggi og virkni þeirra. Það sem er óvenjulegt í tilviki bóluefna gegn COVID-19 bóluefna er hraðinn við þróun þeirra og matsferli Lyfjastofnunar Evrópu (EMA). Þessi flýtimeðferð er til komin vegna verulegrar ógnar faraldursins við lýðheilsu.
Sérstakur COVID-19 starfshópur hefur verið settur á laggirnar, og sinna sérfræðingar í þeim hópi öflugri ráðgjöf til fyrirtækja sem vinna að þróun lyfja og bóluefna gegn sjúkdómnum, á hvaða stigi málsins sem er. Nú þegar hefur ráðgjöf verið veitt vegna fjölda lyfja sem eru eða hafa verið í þróun. Ráðgjöf þessi getur bæði verið óformleg ráðgjöf eða þá formleg vísindaráðgjöf. Sérfræðingar Lyfjastofnunar koma að því að veita umrædda ráðgjöf með aðkomu að vísindastarfi EMA.
Matsferli fyrir bóluefni gegn COVID-19
https://www.lyfjastofnun.is/covid-19/boluefni-gegn-covid-19/
HEIMILDIR
BLS 15 – 104 Í PFIZER BIONTECH BÓLUEFNA SAMNINGNUM ➡️
https://www.rai.it/dl/doc/2021/04/17/1618676600910_APA%20BioNTech%20Pfizer__.pdf
Reglugerð um klínískar lyfjarannsóknir á mönnum.
https://mittval.is/samkvaemt-innihaldslysingu-og-fylgisedli-pfizer-boluefnisins-comirnaty-tha-getur-thu-ekki-fengid-covid-19-af-thvi-ad-thad-inniheldur-ekki-veiru-til-myndunar-onaemis/
https://www.lyfjastofnun.is/lyf/kliniskar-lyfjarannsoknir/umsokn-um-kliniska-lyfjarannsokn/
https://www.reglugerd.is/reglugerdir/allar/nr/443-2004
https://www.lyfjastofnun.is/frettir/sidasti-dagur-til-ad-senda-inn-umsokn-um-kliniska-lyfjarannsokn-a-arinu-2017-er-15-desember-2017/
https://www.visir.is/g/20212070326d
Upplýst Samþykki ; Lög; reglugerðir um hvernig á að upplýsa þáttakendur í klínískri lyfjarannsókn
Sóttvarnalæknir getur leitað aðstoðar lögreglu við að handtaka fólk samkvæmt nýju frumvarpi
Um höfund

- Sigurlaug Ragnarsdóttir
- ✞༺(((( Ⓒilla ℜągnąℜṧ )))༻♚༺ BA Classical Art Historian || MA Culture & Media || Tourism & Sales Management || Web Design || Photo & Videographer for Tourism Magasins ༻
Síðustu færslur
 PROTECT THE CHILDREN23. nóvember, 2024BARNAMÁLARÁÐSTEFNAN 2024
PROTECT THE CHILDREN23. nóvember, 2024BARNAMÁLARÁÐSTEFNAN 2024 MANNRÉTTINDI19. nóvember, 2024MENNTASPJALL VALGERÐAR SNÆLAND JÓNSDÓTTUR
MANNRÉTTINDI19. nóvember, 2024MENNTASPJALL VALGERÐAR SNÆLAND JÓNSDÓTTUR Sigurlaug Ragnarsdóttir15. ágúst, 2024‘Really Chilling’: Five Countries to Test European Vaccination Card
Sigurlaug Ragnarsdóttir15. ágúst, 2024‘Really Chilling’: Five Countries to Test European Vaccination Card MANNRÉTTINDI9. ágúst, 2024Lög um borgaralega handtöku voru felld úr gildi árið 2008
MANNRÉTTINDI9. ágúst, 2024Lög um borgaralega handtöku voru felld úr gildi árið 2008