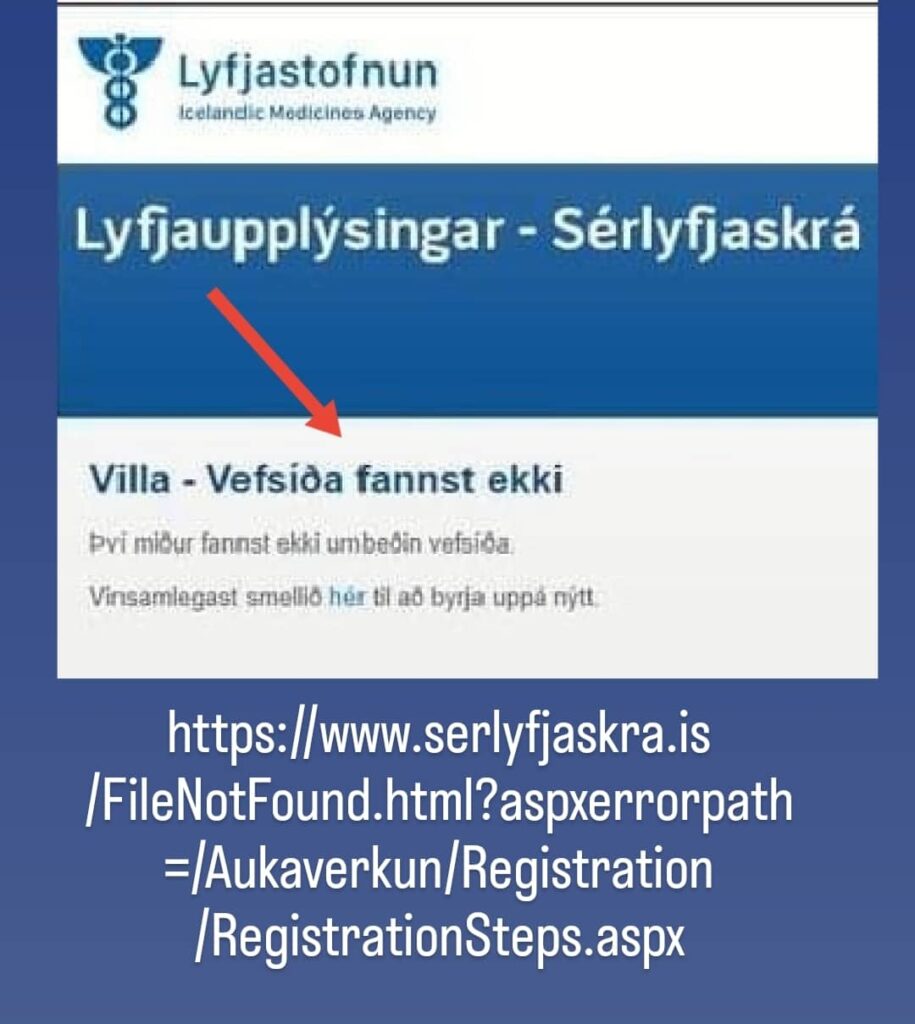
Ég uppgötvaði þessa breytingu fyrir nokkrum dögum síðan þar sem ég var hjálpa eldri manni að tilkynna slæmar aukaverkanir sínar til Lyfjastofnunar, en það er eitthvað sem ég oft gert áður fyrir fólk sem leitar til mín í vandræðum enda er þetta ekki auðvelt í framkvæmdum.
Þannig að ég þekki vel til en ég ákvað samt að bíða í nokkra daga og sjá hvort að heimasíða Lyfjastofnunar væri kannski í uppfærslu en svo reyndist ekki.
Svo var það í gær að annar maður hafði samband við mig út af frænda sínum sem er veikur af aukaverkunum en ég get hjálpað hvorugum þeirra núna þar sem það er ekki lengur í boði hjá Rúnu Kvaran og Lyfjastofnun.
HEIMASÍÐA LYFJASTOFNUNAR
Tilkynningar, bæði frá þeim sem hafa fengið bólusetningu sem og heilbrigðisstarfsfólki, eru mikilvægar. Fólk er sérstaklega hvatt til að tilkynna grun um nýjar, óvæntar og alvarlegar aukaverkanir.
Allir geta tilkynnt aukaverkun lyfja þ.m.t. bóluefna =>HLEKKUR VIRKAR EKKI ![]()
Aðstandendur og starfsfólk, t.d. á dvalarheimilum, geta einnig tilkynnt um aukaverkun fyrir skjólstæðinga. Lögð er sérstök áhersla á að tilkynntar séu nýjar aukaverkanir (aukaverkanir sem ekki eru þekktar og er þar af leiðandi ekki getið í fylgiseðlinum), og alvarlegar aukaverkanir (aukaverkanir sem t.d. kalla á innlögn á sjúkrahús).
Ef heilbrigðisstarfsmaður hefur grun um alvarlega, nýja eða óvænta aukaverkun af notkun lyfs í störfum sínum er honum skylt að tilkynna það til Lyfjastofnunar.
Tilkynna aukaverkun hér =>HLEKKUR VIRKAR EKKI ![]()
,,Birtingu sundurliðunar“ af þessu tagi hætt segir á heimasíðu Lyfjastofnunar Íslands
Sundurliðun tilkynninga vegna gruns um aukaverkun í kjölfar bólusetningar gegn COVID-19 hefur verið birt með reglulegu millibili frá 8. júní 2021. Í ljósi þess að tilkynningum hefur fækkað til muna verður nú birtingu sundurliðunar af þessu tagi hætt. Í hverjum mánuði er fjallað um tilkynntar aukaverkanir í almennri sundurliðun og er áhugasömum bent á þær upplýsingar.
Tölfræði um tilkynningar vegna gruns um aukaverkun verður áfram aðgengileg á vef Lyfjastofnunar.
LEYNILEGA KLÍNÍSKA LYFJARANNSÓKNIN Á ÍSLENDINGUM HÓFST Í ÁRSBYRJUN 2021 OG STENDUR FRAM Í TVEIMUR ÁFÖNGUM TIL ÁRSLOKA 2026
Þeir fullorðnu einstaklingar og þeir foreldrar barna sem hafa tekið þátt í þessari leynilegu klínísku lyfjatilraun hafa aldrei verið upplýstir um að þeir séu að taka þátt í lyfjatilraun á vegum lyfjarisanna.
Comirnaty tilraunabóluefnið frá Pfizer, er með neyðarleyfi til desember og stendur klíníska undanfara lyfjarannsóknin til desemeber 2023, en aðallyfjarannsóknin hefst í janúar 2024 og stendur til ársins 2026.
Það er kemur fram samkvæmt ákvæðum:
á bls 15, í Pfizer & EU bóluefnasamningum
á bls 50 – 58 í Comirnaty Innihaldsskýrslunni frá Pfizer
á bls 44 – 130 í Comirnaty Epar Risk management Plan

Reglugerð um klínískar lyfjarannsóknir á mönnum.

https://www.lyfjastofnun.is/lyf/kliniskar-lyfjarannsoknir
29. gr.
Tilkynningarskylda vegna meintilvika.
- Rannsakandi skal tafarlaust tilkynna bakhjarli um öll alvarleg meintilvik sem ekki er lýst í rannsóknaráætlun, í upplýsingariti rannsakanda og/eða í samantekt um lyf (SPC).
- Ítarlegar skriflegar upplýsingar má senda seinna til bakhjarls.
- Bakhjarl gefur tilkynningunni sérstakt númer.Rannsakandi tilkynnir bakhjarli um öll meintilvik og/eða rannsóknarniðurstöður utan öryggismarka rannsóknarinnar.
- Ef meintilvik er dauðsfall skal rannsakandi, tilkynna það bakhjarli, Lyfjastofnun og viðkomandi siðanefnd og þeir aðilar geta krafist nánari gagna.
30. gr.
Tilkynningarskylda vegna aukaverkana.
- Bakhjarl skal sjá til þess að Lyfjastofnun og viðkomandi siðanefnd sé tilkynnt um allar alvarlegar aukaverkanir, sem upp kunna að koma.
- Ef enginn bakhjarl er tengdur rannsókninni, sbr. i-lið 2. gr. hvílir þessi skylda á aðalrannsakanda eða eftir atvikum rannsakanda.
Eftirfarandi tímafrestur gildir fyrir þessar tilkynningar:
| a. | Aukaverkun sem leiðir til dauða eða óvænts lífshættulegs ástands af völdum rannsóknarlyfs, skal tilkynnt þegar í stað eða innan viku (7 daga) frá því atvikið átti sér stað. |
| b. | Allar ætlaðar alvarlegar og/eða óvæntar aukaverkanir skal tilkynna innan 15 daga. |
31. gr.
Tilkynningarskylda vegna breytinga á rannsókn.
- Aðalrannsakandi, eða eftir atvikum rannsakandi, umsjónaraðili rannsóknar ef um fjölsetra rannsókn er að ræða, bakhjarl eða fulltrúi hans skulu senda skriflega rökstudda tilkynningu til Lyfjastofnunar og viðkomandi siðanefndar þegar breytingar eru gerðar á rannsóknaráætlun:
| a. | Ef mögulegt er að breytingar verði á öryggi sjúklinga. |
| b. | Ef breytingin hefur í för með sér breytingu á túlkun á niðurstöðum. |
| c. | Ef um verulegar breytingar á áður samþykktri rannsóknaráætlun er að ræða. |
- Bakhjarl skal láta Lyfjastofnun vita um:
| a. | Þegar tafir verða á því að rannsóknin hefjist. |
| b. | Þegar rannsókninni er hætt fyrir áætluð lok. |
- Lyfjastofnun og viðkomandi siðanefnd meta og þurfa að samþykkja verulegar breytingar í áður tilgreindri rannsóknaráætlun áður en þær taka gildi, sbr. 12. – 17. gr.
32. gr.
Tilkynningarskylda vegna breytinga á rannsóknarlyfi o.fl.
- Aðalrannsakandi, eða eftir atvikum rannsakandi, skal tilkynna til Lyfjastofnunar allar verulegar breytingar, sem gerðar eru á skráningargögnum lyfja sem notuð eru í klínískum rannsóknum m.a.:
| a. | Allar breytingar á efnafræðilegum eða lyfjafræðilegum skráningargögnum. |
| b. | Allar breytingar á lyfjafræði, eiturefnafræði og klínískum heimildum sem geta haft þýðingu fyrir framhald rannsóknarinnar. |
Tilkynningar samkvæmt þessari grein skulu gerðar í samræmi við 12. – 17. gr.
33. gr.
Ársskýrsla og lokaskýrsla.
Þegar rannsókn varir lengur en eitt ár skal senda ársskýrslu til Lyfjastofnunar og viðkomandi siðanefndar, þar sem greint er frá stöðu rannsóknarinnar svo og samantekt á öllum alvarlegum meintilvikum, sbr. 29. gr. og 30. gr.
Í síðasta lagi ári eftir að rannsókninni er lokið á að senda lokaskýrslu til Lyfjastofnunar og viðkomandi siðanefndar.
- Ef magn upplýsinga, sem vinna þarf úr er umtalsvert, er hægt að senda inn beiðni um framlengingu frestsins til þess að skila inn lokaskýrslu.
- Það sama á við ef aðrar sérstakar ástæður valda því að ekki er hægt að ljúka gerð lokaskýrslu innan eins árs frá lokum rannsóknarinnar.
- Lokaskýrslan á að vera stutt samantekt á helstu niðurstöðum og mat á þeim ásamt samantekt yfir öll meintilvik.
- Aðalrannsakandi, bakhjarl eða fulltrúi hans skal senda lokaskýrsluna, nema þegar um fjölsetra rannsókn er að ræða, þá skal umsjónaraðili rannsóknar senda lokaskýrsluna.
Ef klínísk rannsókn er gerð í samvinnu við bakhjarl eða fulltrúa hans bera þeir einnig ábyrgð á að ársskýrsla og lokaskýrsla séu sendar Lyfjastofnun og viðkomandi siðanefnd.
VI. KAFLI
Eftirlit, stöðvun og viðurlög.
34. gr.
Opinber eftirlitsaðili.
- Lyfjastofnun hefur eftirlit með að ákvæðum þessarar reglugerðar sé fylgt við framkvæmd klínískra rannsókna, sbr. 45. gr. lyfjalaga nr. 93/1994 með síðari breytingum.
35. gr.
Eftirlit.
- Lyfjastofnun er heimilt að framkvæma eftirlit á starfsemi allra þeirra sem taka þátt í framkvæmd klínískra rannsókna bæði meðan á rannsókn stendur en einnig eftir að rannsókn er lokið.
- Starfsmenn Lyfjastofnunar eru bundnir þagnarskyldu um allt er þeir kunna að verða varir við í eftirlitsstörfum sínum.
36. gr.
Stöðvun klínískra rannsókna.
-
Lyfjastofnun getur stöðvað tímabundið eða bannað framkvæmd klínískrar rannsóknar með tilliti til öryggis sjúklinga, þegar framkvæmd rannsóknarinnar er á einhvern hátt ábótavant eða ef aðrar gildar ástæður liggja fyrir.
- Lyfjastofnun skal tilkynna bakhjarli rannsóknar um ákvörðun sína.
- Um afturköllun samþykkis vísindasiðanefndar eða eftir atvikum siðanefndar viðkomandi stofnunar fer skv. 6. gr. reglugerðar um vísindarannsóknir á heilbrigðissviði.
37. gr.
Viðurlög.
Brot gegn ákvæðum reglugerðar þessarar varða viðurlögum samkvæmt ákvæðum
XV. kafla lyfjalaga nr. 93/1994 með síðari breytingum.
Um mál sem rísa kunna út af brotum á reglugerð þessari fer að hætti opinberra mála.
Umsókn um klíníska lyfjarannsókn á mönnum þarf að fara fyrir Lyfjastofnun, Vísindasiðanefnd og Persónuvernd
– Engin umsókn hafði borist frá Pfizer þremur mánuðum eftir að C-19 bólusetningar hófust á Íslandi og finnst hvergi.
júlí 18, 2022
Klínísk lyfjarannsókn – Umsókn um klíníska lyfjarannsókn á mönnum þarf að fara fyrir Lyfjastofnun, Vísindasiðanefnd og Persónuvernd. Það þarf líka að að gefa upp sé aðalrannsakandi lyfjarannsóknarinnar er og hver sé ábyrgðaraðili sem er í þessu tilfelli Lyfjastofnun og þá undir eftiræiti Landlæknis. Þá á rannsóknin að vera aðgengileg almenningi á heimasíðu lyfjastofnunarinnar en það er hún ekki.
Umsókn um klíníska lyfjarannsókn
Sækja þarf um leyfi til framkvæmdar klínískrar lyfjarannsóknar til Lyfjastofnunar. Lyfjastofnun þarf að samþykkja framkvæmd klínískra lyfjarannsókna á Íslandi
Bakhjarl (einstaklingur/fyrirtæki) þarf alltaf að sækja um leyfi til Lyfjastofnunar fyrir framkvæmd klínískrar lyfjarannsóknar. Aðalrannsakandi þarf alltaf að vera til staðar við framkvæmd klínískrar lyfjarannsóknar.
Lyfjastofnun fer yfir gæði rannsóknarinnar og rannsóknarlyfsins ásamt að tryggja öryggi þátttakenda í klínískri lyfjarannsókn.






https://www.serlyfjaskra.is/FileNotFound.html?aspxerrorpath=/Aukaverkun/Registration/RegistrationSteps.aspx

Lyfjastofnun: 6192 tilkynningar um aukaverkanir þar af 34 lífshættulegar, m.a börn og 12 fósturlát sem þessi tilraunlyf hafa valdið á Íslandi.

https://www.lyfjastofnun.is/covid-19/aukaverkanatilkynningar-vegna-covid-19/
COVID-19: Sundurliðun tilkynninga vegna gruns um alvarlega aukaverkun í kjölfar bólusetningar
Lyfjastofnun hefur hvatt alla, jafnt heilbrigðisstarfsfólk, einstaklinga og aðstandendur til að tilkynna grun um aukaverkun eftir bólusetningu gegn COVID-19 til Lyfjastofnunar. Tölulegar upplýsingar um fjölda og alvarleika tilkynntra tilvika hafa verið uppfærðar daglega á vef stofnunarinnar.
Mikilvægt er að hafa hugfast að fjöldi tilkynninga vegna gruns um aukaverkun segir ekki til um tíðni raunverulegra aukaverkana eftir bólusetningu eða öryggi bóluefna. Slíkar tilkynningar eru notaðar til að fylgjast með öryggi lyfja eftir að notkun þeirra hefst og er það gert m.a. með því að meta hvort líkur séu á því að orsakasamband sé milli lyfjanotkunar og þess tilviks sem tilkynnt er. Þannig er ekki víst að tilkynningarnar endurspegli raunverulegar aukaverkanir af bóluefnunum. Þekktar aukaverkanir allra bóluefnanna má finna í fylgiseðlum þeirra í sérlyfjaskrá.
Sundurliðun tilkynninga
Til dagsins í dag hafa 293 tilkynningar vegna gruns um alvarlega aukaverkun* borist Lyfjastofnun. Skiptast þær svo milli bóluefnanna:
Comirnaty (BioNTech/Pfizer):
149 alvarlegar tilkynningar hafa borist.
- 27 þeirra varða andlát. 18 andlát vörðuðu aldraða** einstaklinga, 15 þeirra með staðfesta undirliggjandi sjúkdóma. Sjö andlát vörðuðu eldri*** einstaklinga, fjórir þeirra með staðfesta undirliggjandi sjúkdóma. Tvö andlát varða einstaklinga á aldursbilinu 55-64 ára, þar sem annar þeirra var með staðfestan undirliggjandi sjúkdóm.
- 80 tilkynningar varða sjúkrahúsvist (þar af þrettán lífshættulegt ástand).
- 26 tilkynningar teljast klínískt mikilvægar og þar með flokkaðar sem alvarlegar****.
- Ellefu tilkynningar teljast alvarlegar, þar sem beðið er eftir viðbótar upplýsingum.
- Fimm tilkynningar varða fósturmiska.
Spikevax (Moderna):
41 alvarlegar tilkynningar hafa borist.
- Ein tilkynning varðar andlát aldraðs** einstaklings.
- 30 tilkynningar varða sjúkrahúsvist (þar af tvær lífshættulegt ástand).
- Ein tilkynning varðar lífshættulegt ástand þar sem ekki kom til sjúkrahúsvistar.
- Fjórar tilkynningar teljast klínískt mikilvægar og þar með flokkaðar sem alvarlegar****.
- Ein tilkynning telst alvarleg, þar sem beðið er eftir viðbótar upplýsingum.
- Fjórar tilkynningar varða fósturmiska.
Vaxzevria (AstraZeneca):
84 alvarlegar tilkynningar hafa borist.
- Sjö tilkynningar varða andlát; fjögur andlát varða eldri*** einstaklinga, tveir þeirra með staðfesta undirliggjandi sjúkdóma. Þrjár tilkynningar varða andlát einstaklinga á aldursbilinu 60-64 ára; Einn þeirra var með staðfestan undirliggjandi sjúkdóm.
- 60 tilkynningar varða sjúkrahúsvist (þar af 24 lífshættulegt ástand).
- 13 tilkynningar teljast klínískt mikilvægar og þar með flokkaðar sem alvarlegar****.
- Þrjár tilkynningar teljast alvarlegar, þar sem beðið er eftir viðbótar upplýsingum.
- Ein tilkynning varðar fósturmiska.
COVID-19 Vaccine Janssen:
19 alvarlegar tilkynningar hafa borist.
- Ein tilkynning varðar andlát eldri*** einstaklings
- 13 tilkynningar varða sjúkrahúsvist (þar af þrjár lífshættulegt ástand).
- Þrjár tilkynningar teljast klínískt mikilvægar og þar með flokkaðar sem alvarlegar****.
- Ein tilkynning telst alvarleg, þar sem beðið er eftir viðbótar upplýsingum.
- Ein tilkynning varðar fósturmiska.
*Alvarleg aukaverkun er aukaverkun eða óæskileg áhrif lyfs sem leiðir til dauða, lífshættulegs ástands, sjúkrahúsvistar eða lengingar á sjúkrahúsvist, veldur fötlun eða fæðingargalla hjá mönnum.
** Aldraðir einstaklingar eru hér skilgreindir 75 og eldri.
*** Eldri einstaklingar eru hér skilgreindir á aldursbilinu 65-74 ára.
****Tilkynningar sem metnar eru sem klínískt mikilvægar geta varðað ýmis einkenni, t.d. blóðtappa þar sem ekki kom til innlagnar á sjúkrahús.
Fjöldi tilkynninga vegna gruns um aukaverkanir og alvarlega aukaverkun í kjölfar bólusetningar í aldurshópnum 5-11 ára:
- Tólf tilkynningar hafa borist og þar af er engin alvarleg.
Fjöldi tilkynninga vegna gruns um aukaverkanir og alvarlega aukaverkun í kjölfar bólusetningar í aldurshópnum 12-15 ára:
- 44 tilkynningar hafa borist og þar af eru fjórar alvarlegar.
Tilkynningar um aukaverkanir í kjölfar bólusetningar með örvunarskammti
- Í ágúst 2021 bárust þrjár tilkynningar um alvarlegar aukaverkanir sem tengdust örvunarbólusetningu. Tvær þeirra vörðuðu bóluefnið Comirnaty og ein Spikevax.
- Í september 2021 barst ein tilkynning um alvarlega aukaverkun sem varðaði örvunarbólusetningu með Comirnaty.
- Í október 2021 bárust fjórar tilkynningar um alvarlegar aukaverkanir vegna örvunarbólusetningar. Tvær þeirra vörðuðu bóluefnið Comirnaty og hinar tvær Spikevax.
- Í nóvember 2021 bárust fjórar tilkynningar um alvarlegar aukaverkanir í kjölfar örvunarbólusetningar og vörðuðu þær allar bóluefnið Comirnaty.
- Í desember 2021 bárust sex tilkynningar um alvarlegar aukaverkanir vegna örvunarbólusetningar. Fjórar þeirra vörðuðu bóluefnið Comirnaty og hinar tvær Spikevax.
- Í janúar 2022 bárust fjórar tilkynningar um alvarlegar aukaverkanir sem tengdust örvunarbólusetningu. Þrjár þeirra vörðuðu bóluefnið Comirnaty og ein Spikevax.
- Í febrúar 2022 liggja tölur ekki fyrir um alvarlegar aukaverkanir sem tengdust örvunarbólusetningu.
- Tölur um alvarlegar aukaverkanir varðandi örvunarbólusetningu í mars 2022 liggja ekki fyrir.
- Tölur um alvarlegar aukaverkanir sem varða örvunarbólusetningu í apríl 2022 liggja ekki fyrir.
Tilkynningar um andlát
Rétt er að geta þess að flestar tilkynningar um andlát í kjölfar bólusetningar gegn COVID-19 bárust í janúar 2021, þegar elsti og hrumasti hópurinn var bólusettur hérlendis. Sérstök rannsókn var framkvæmd af embætti landlæknis í kjölfar fyrstu fimm alvarlegu tilkynninganna vegna gruns um aukaverkun og voru niðurstöður birtar síðar í mánuðinum.
- Átta tilkynningar um andlát í kjölfar bólusetningar bárust í janúar 2021.
- Tvær tilkynningar um andlát í kjölfar bólusetningar bárust í febrúar 2021.
- Fimm tilkynningar um andlát í kjölfar bólusetningar bárust í mars 2021.
- Ein tilkynning um andlát í kjölfar bólusetningar barst í apríl 2021.
- Fjórar tilkynningar um andlát í kjölfar bólusetningar bárust í maí 2021.
- Sex tilkynningar um andlát í kjölfar bólusetningar bárust júní 2021.
- Ein tilkynning um andlát í kjölfar bólusetningar barst í júlí 2021.
- Fjórar tilkynningar um andlát í kjölfar bólusetningar bárust í ágúst 2021.
- Engin tilkynning um andlát í kjölfar bólusetningar barst í september 2021.
- Ein tilkynning um andlát í kjölfar bólusetningar barst í október 2021.
- Engin tilkynning um andlát í kjölfar bólusetningar barst í nóvember 2021.
- Tvær tilkynningar um andlát í kjölfar bólusetningar bárust í desember 2021.
- Tvær tilkynningar um andlát í kjölfar bólusetningar bárust í janúar 2022.
- Engin tilkynning um andlát í kjölfar bólusetningar barst í febrúar 2022.
- Engin tilkynning um andlát í kjölfar bólusetningar barst í mars 2022.
- Engin tilkynning um andlát í kjölfar bólusetningar hefur borist í apríl 2022.
Að svo komnu er ekkert bendir til orsakasamhengis milli tilkynntra andláta og bólusetninga gegn COVID-19.
Tilfelli rannsökuð
Þann 6. ágúst sl. var tilkynnt um nýja rannsókn á tilkynningum vegna gruns um röskun á tíðahring í kjölfar bólusetningar gegn COVID-19. Niðurstöður rannsóknarinnar, sem var gerð af óháðum sérfræðingum, var kynnt 7. október sl. Niðurstöður rannsóknarinnar var að ekki sé með óyggjandi hætti hægt að útiloka tengsl nokkurra tilfella sem áttu sér stað í kringum tíðahvörf og hluta tilfella sem vörðuðu óreglulegar og langvarandi blæðingar við bólusetningar. Hins vegar telur nefndin tengsl á milli bólusetningar og fósturláta hér á landi ólíkleg. Sjá nánar í frétt á vef okkar.
Þann 20. maí sl. var tilkynnt um nýja rannsókn sem framkvæmd var á 5 tilkynningum um andlát og 5 tilkynningum um myndun blóðtappa í kjölfar bólusetningar gegn COVID-19. Niðurstöður þeirrar rannsóknar voru tilkynntar 11. júní sl., sjá nánar í frétt á vef okkar.
Orsakasamsamhengi metið
Þegar tilkynningar berast Lyfjastofnun er ekki hægt að segja til um hvort um orsakasamhengi milli bólusetningar og tilkynntra tilvika sé að ræða. Skoðun á öllum tilkynningum fer eftir ferlum hefðbundins lyfjagátarkerfis Lyfjastofnunar. Lyfjastofnun óskar eftir nánari upplýsingum um tilkynnt tilvik þegar slíkar upplýsingar eru taldar geta varpað betra ljósi á tilvikin. Tilkynningarnar eru yfirfarnar af sérfræðingum Lyfjastofnunar og sendar í samevrópskan gagnagrunn fyrir tilkynningar um grun um aukaverkanir (EudraVigilance). Í þeim grunni eru tilkynningarnar metnar ásamt öllum öðrum tilkynntum tilvikum á EES-svæðinu. Þannig er hægt að meta upplýsingar í hverju tilfelli fyrir sig en einnig skoða samnefnara á milli tilfellanna, en reynist mynstur svipað í tilkynntum tilfellum styður það að orsakasamhengi kunni að vera mögulegt eða líklegt. Nýjar upplýsingar um öryggi lyfja leiða til þess að fylgiseðlar þeirra eru uppfærðir.
Fyrirvarar við notkun upplýsinganna
Lyfjastofnun vekur sérstaka athygli á að gera verður eftirfarandi fyrirvara við lestur, túlkun og notkun framangreindra upplýsinga:
- Fjöldi tilkynninga skal skoðaður í samhengi við fjölda þeirra sem bólusettir hafa verið. Upplýsingar um fjölda bólusettra með hverju bóluefni fyrir sig má finna á covid.is.
- Þar sem bóluefnin hafa ekki borist á sama tíma er óhjákvæmilegt að ólíkt samsettir hópar fái mismunandi bóluefni. Það gerir beinan samanburð milli þeirra ómögulegan. Í fyrstu forgangshópum bólusetningar var meðal annars heilbrigðisstarfsfólk, en því ber skylda til að tilkynna um aukaverkanir samkvæmt lyfjalögum og hefur þessi skylda áhrif á fjölda tilkynninga, og þá til fjölgunar þeirra, að mati Lyfjastofnunar. Auk heilbrigðisstarfsmanna voru aldraðir einstaklingar fremstir í forgangi bólusetningar. Margir þeirra hafa undirliggjandi sjúkdóma. Því má búast við fleiri tilkynningum vegna bólusetningar í þeim hópi, en hins vegar þarf ekki að vera um orsakasamband að ræða milli bólusetningar og tilkynntra tilvika. Slíkt er metið í hverju tilfelli fyrir sig. Aldursdreifingu fyrir hvert bóluefni má sjá á covid.is.
Birtingu sundurliðunar af þessu tagi hætt
Sundurliðun tilkynninga vegna gruns um aukaverkun í kjölfar bólusetningar gegn COVID-19 hefur verið birt með reglulegu millibili frá 8. júní 2021. Í ljósi þess að tilkynningum hefur fækkað til muna verður nú birtingu sundurliðunar af þessu tagi hætt. Í hverjum mánuði er fjallað um tilkynntar aukaverkanir í almennri sundurliðun og er áhugasömum bent á þær upplýsingar.
Tölfræði um tilkynningar vegna gruns um aukaverkun verður áfram aðgengileg á vef Lyfjastofnunar.
- Fjöldi allra tilkynninga, sem Lyfjastofnun hafa borist, er uppfærður alla virka daga.
- Sundurliðun yfirfarinna tilkynninga sem sendar hafa verið inn í samevrópskan gagnagrunn um aukaverkanir (EudraVigilance) er uppfærð á mánudögum kl. 11:00.

Um höfund

- Sigurlaug Ragnarsdóttir
- ✞༺(((( Ⓒilla ℜągnąℜṧ )))༻♚༺ BA Classical Art Historian || MA Culture & Media || Tourism & Sales Management || Web Design || Photo & Videographer for Tourism Magasins ༻
Síðustu færslur
 PROTECT THE CHILDREN23. nóvember, 2024BARNAMÁLARÁÐSTEFNAN 2024
PROTECT THE CHILDREN23. nóvember, 2024BARNAMÁLARÁÐSTEFNAN 2024 MANNRÉTTINDI19. nóvember, 2024MENNTASPJALL VALGERÐAR SNÆLAND JÓNSDÓTTUR
MANNRÉTTINDI19. nóvember, 2024MENNTASPJALL VALGERÐAR SNÆLAND JÓNSDÓTTUR MANNRÉTTINDI9. ágúst, 2024Lög um borgaralega handtöku voru felld úr gildi árið 2008
MANNRÉTTINDI9. ágúst, 2024Lög um borgaralega handtöku voru felld úr gildi árið 2008 Sameinuðu Þjóðirnar28. desember, 2023Lestrarefni Menntamálastofnunar: Varúð hér býr vampíra – auðlesin sögubók á léttu máli og bókinni fylgir verkefnahefti sem hægt er að vinna samhliða lestri.
Sameinuðu Þjóðirnar28. desember, 2023Lestrarefni Menntamálastofnunar: Varúð hér býr vampíra – auðlesin sögubók á léttu máli og bókinni fylgir verkefnahefti sem hægt er að vinna samhliða lestri.