MIKILVÆGASTA SPURNINGIN SEM ÞÚ SEM FORELDRI ÁTT EFTIR AÐ ÞURFA AÐ SVARA!

SKAÐSEMI ÞESSARA BÓLUEFNA VERÐA EKKI AFTUR TEKIN
Dr. Robert Malone, veirufræðingur og ónæmisfræðingur sem hefur lagt mikilvægt af mörkum til tækni mRNA bóluefna, gaf út eindregna viðvörun til þeirra sem leitast við að láta bólusetja börn sín gegn COVID-19.
„Hugsaðu þig tvisvar um áður en þú bólusetur börnin þín. Vegna þess að ef eitthvað slæmt gerist geturðu ekki farið til baka og sagt: „Úff, ég vil taka þetta tilbaka”.
„Það er ljóst að foreldrar ættu að hugsa sig tvisvar um að bólusetja barnið sitt,“ og bætti við að alvarlegir aukaverkanir geta komið og geta verið „svo alvarlegar að það setur barnið þitt á sjúkrahús.“
[Varðandi] hjartavöðvabólgu, eða bólgu í hjarta, „eru góðar líkur á því að ef barnið þitt fær bóluefnið muni það ekki skemmast, það mun ekki sýna klínísk einkenni – það gæti haft óljósan skaða” á hjartanu sem kæmi fram síðar á ævinni.
What parents need to know before jabbing their little kids
Dr. Charles Hoffe is a family physician who works with COVID-19 vaccine adverse reaction patients.
Í yfirlýsingu Rúnu Hvannberg, forstjóra Lyfjastofnunar segir hún Comirnaty tilraunabóluefnið frá Pfizer hvorki vera tilrauna lyf né á neyðarleyfi.
- Hvernig má það vera?, þegar að sjálfur heilbrigðisráðherra Willum Þór heilbrigðisráðherra sagði á fundi velferðarnefndar Alþingis að það væru engar staðfestar rannsóknir til um hvaða áhrif bólusetningar gegn Covid-19 hafa á börn og þær myndu ekki liggja fyrir fyrr en á árinu 2026. Þar með viðurkenndi ráðherra að um tilraunir með líftæknilyf séu að ræða. Í sama streng taka þau Óskar Reykdalsson forstjóri Heilsugæslunnar á höfuðborgarsvæðinu og Kamilla Jósefsdóttir aðstoðarmaður Landlæknis sem segir lítið sem ekkert vitað um áhrif bóluefnanna á hormónastarfsemi barna. Kamilla Sigríður var spurð út í það hvort vitað væri um hvaða áhrif bólusetningarnar hefðu á hormónastarfsemi barna sem séu á kynþroskaskeiði sagði Kamilla að lítil væri vitað um hvaða áhrif bólusetningarnar hefðu á hormónastarfsemina:
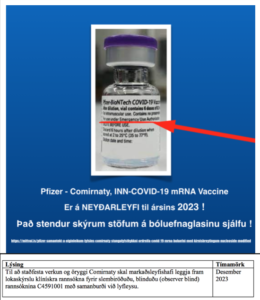
TÍMABUNDIÐ LEYFI og ÞAÐ STENDUR UTAN Á LYFJAGLASINU
COVID-19 mRNA bóluefni BNT162b2 þykkni fyrir stungulyf, lausn Tozinameran. Þetta lyf hefur fengið leyfi til tímabundinnar afhendingar af breska heilbrigðis- og félagsmálaráðuneytinu og lyfja- og heilbrigðiseftirlitsstofnuninni. Það hefur ekki markaðsleyfi en þetta tímabundna leyfi veitir leyfi fyrir því að lyfið sé notað til virkra ónæmisaðgerða til að koma í veg fyrir COVID-19 sjúkdóm af völdum SARS-CoV-2 veiru hjá einstaklingum 12 ára og eldri.
Package Information : https://mittval.is/wp-content/uploads/2022/01/Temporary_Authorisation_Patient_Information_BNT162_18_0_UK_Clean-1.pdf
FARA FRAM Á AFTURKÖLLUN MARKAÐSLEYFIS Á GRUNDVELLI LYFJALAGA
Margrét Friðriksdóttir, blaðamaður Fréttarinnar spurði tveggja spurninga. Annarri þeirra var beint til Þórólfs: ,,Þórólfur ég er með eina spurningu til þín þar sem þú ert barnalæknir. Er sóttvarnaryfirvöldum kunnugt um af hverju hjartalyfinu Tromethamine (Trómetamín) var bætt við Pfizer mRNA bóluefnið fyrir börn 5-11 ára, en efnið hefur verið notað vegna hjartavandamála fullorðins fólks.“
Þórólfur svaraði:,,Ég skoðaði þetta síðast í gær og mér er ekki kunnugt um að þessu lyfi hafi verið bætt í bóluefni barna og ég veit ekki hvaðan þú hefur það.“
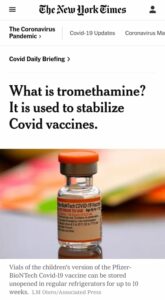
Margrét svarar: ,,Hjá FDA sem er lyfja-og matvælaeftirlit Bandaríkjanna.“ Þetta má lesa orðrétt á bls. 14 í skýrslu sem lögð var fyrir FDA vegna beiðni um bráðabirgðaleyfið, 26. október 2021:
- „To provide a vaccine with an improved stability profile, the Pfizer-BioNTech COVID-19 Vaccine for use in children 5-11 years of age uses tromethamine (Tris) buffer instead of the phosphatebuffered saline (PBS) as used in the previous formulation and excludes sodium chloride and potassium chloride. The packaged vials for the new formulation are stored frozen at -90°C to -60°C. The frozen vials may be thawed and stored at refrigerator at 2°C to 8°C for up to 10 weeks.“https://www.fda.gov/media/153447/download
Í tilkynningu frá FDA segir einnig:
„FDA Authorizes Pfizer-BioNTech COVID-19 Vaccine for Emergency Use in Children 5 through 11 Years of Age”
Data Supports New Vaccine Formulation to Improve Stability and Storage Conditions
- The FDA today also authorized a manufacturing change for the vaccine to include a formulation that uses a different buffer; buffers help maintain a vaccine’s pH (a measure of how acidic or alkaline a solution is) and stability.
- This new formulation is more stable at refrigerated temperatures for longer periods of time, permitting greater flexibility for vaccination providers.
- The new formulation of the vaccine developed by Pfizer Inc. contains Tris buffer, a commonly used buffer in a variety of other FDA-approved vaccines and other biologics, including products for use in children.
- The FDA evaluated manufacturing data to support the use of Pfizer-BioNTech COVID-19 Vaccine containing Tris buffer and concluded it does not present safety or effectiveness concerns.
comirnaty-appendix-v-adverse-drug-reaction-reporting-details_en (1)
COMIRNATY RISK MANAGEMENT PLAN 2021
BÖRN
Kafli 4.2 – 4.6 á bls 3 – 5
Ekki hefur enn verið sýnt fram á öryggi og verkun Comirnaty hjá börnum yngri en 12 ára.
Takmarkaðar upplýsingar liggja fyrir.
Gefa má einstaklingum 18 ára og eldri örvunarskammt (þriðja skammtinn) af Comirnaty að minnsta kosti 6 mánuðum eftir annan skammtinn.
MEÐGANGA
Kafli 4.6 – bls 5
-
Frjósemi, Meðganga og Brjóstagjöf
-
Takmörkuð reynsla liggur fyrir af notkun Comirnaty á meðgöngu.
BRJÓSTAGJÖF
- Ekki er þekkt hvort Comirnaty skilst út í brjóstamjólk.
E. SÉRSTÖK SKYLDA TIL AÐ LJÚKA AÐGERÐUM EFTIR ÚTGÁFU SKILYRTS MARKAÐSLEYFIS
- Þetta lyf hefur fengið markaðsleyfi með skilyrtu samþykki (Neyðarleyfi) og í samræmi við grein 14-a í reglugerð (EB) nr. 726/2004 skal markaðsleyfishafi ljúka eftirfarandi innan tilgreindra tímamarka:
Lýsing Tímamörk : Til að ljúka lýsingu á eiginleikum virka efnisins og fullbúna lyfsins skal markaðsleyfishafi leggja fram viðbótargögn.
Júlí 2021.
Bráðabirgðaskýrslur: 31. mars 2021.
- Til að tryggja samfelld gæði lyfsins skal markaðsleyfishafi veita viðbótarupplýsingar til að bæta eftirlitsaðferðina, þ.m.t. gæðalýsingu á virka efninu og fullbúna lyfinu.
Júlí 2021.
Bráðabirgðaskýrslur: Mars 2021
- Til að staðfesta hreinleika og tryggja alhliða gæðaeftirlit og samræmi á milli lota á öllum framleiðslustigum (lifecycle) fullbúna lyfsins, skal markaðsleyfishafi veita frekari upplýsingar um framleiðsluferlið (synthetic process) og eftirlitsaðferð fyrir hjálparefnið ALC-0315.Júlí 2021. Bráðabirgðaskýrslur:Mars 2021
- Til að staðfesta hreinleika og tryggja alhliða gæðaeftirlit og samræmi á milli lota
á öllum framleiðslustigum (lifecycle) fullbúna lyfsins, skal markaðsleyfishafi
veita frekari upplýsingar um framleiðsluferlið (synthetic process) og
eftirlitsaðferð fyrir hjálparefnið ALC-0315.Júlí 2021. - Bráðabirgðaskýrslur: Janúar 2021, apríl 2021
Til að staðfesta hreinleika og tryggja alhliða gæðaeftirlit og samræmi á milli lota
á öllum framleiðslustigum fullbúna lyfsins, skal markaðsleyfishafi veita frekari
upplýsingar um framleiðsluferlið og eftirlitsaðferð fyrir hjálparefnið ALC-0159. - Júlí 2021. Bráðabirgðaskýrslur: Janúar 2021,apríl 2021
- Lýsing – Tímamörk: Til að staðfesta verkun og öryggi Comirnaty skal markaðsleyfishafi leggja fram lokaskýrslu klínískra rannsókna fyrir slembiröðuðu, blinduðu (observer blind)
rannsóknina C4591001 með samanburði við lyfleysu í Desember 2023
https://www.ema.europa.eu/…/comirnaty-epar-product…
comirnaty-appendix-v-adverse-drug-reaction-reporting-details_en (1)
-
-
FORSTJÓRI LYFJASTOFNUNAR NEFNDI EKKI DAUÐSFÖLL BARNA EFTIR BÓLUSETNINGU Í VIÐTALI STÖÐVAR 2
Í kvöldfréttum Stöðvar 2 í gærkvöldi kom Rúna Hauksdóttir forstjóri Lyfjastofnunar fram í viðtali þar sem hún svaraði spurningum um hættuna og hugsanlegar aukaverkanir af mRNA bóluefni Pfizer sem sóttarvarnaryfirvöld vilja sprauta í 5-11 ára börn hér á landi.
Gefur í skyn að lyfið Tromethamine sé bara hjálparefni Í viðtalinu svaraði Rúna fyrir lyfið Tromethamine (einnig nefnt TRIS) sem Pfizer hefur bætt við í bóluefnið fyrir 5-11 ára börn og Fréttin fjallaði um nýverið.
„Þetta er ekki hjartalyf, þetta er hjálparefni til að stýra sýrustigi. Þetta er algengt hjálparefni. Þetta er meðal annars í Moderna bóluefninu og gerir það að verkum að það er hægt að geyma lyfið lengur í kæli eftir blöndun og verður líka í fullorðinsbóluefninu frá Pfizer sem kemur núna fljótlega“
Í svarinu tekur Rúna ekki fram að bóluefni Moderna er bannað börnum undir 18 ára aldri og því er það ekki notað fyrir börn 5-11 ára en frétt hjá Frettin.is fjallaði um notkun lyfsins Tromethamine í bóluefni fyrir 5-11 ára börn. Þá mætti skilja á svari hennar að Tromethamine væri einungis notað sem hjálparefni í bóluefnum og ekki notað sem lyf en það er alrangt hjá Rúnu.
Hvað er Trómetamín og hvers vegna er það í bóluefninu fyrir 5-11 ára börn?
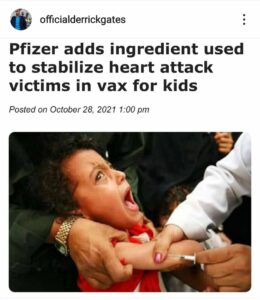
Svo hvað er trómetamín?
- Samkvæmt mörgum læknisfræðiorðabókum á netinu er trómetamín „alkalizer“ gefið í bláæð til að meðhöndla efnaskiptablóðsýringu (of mikil sýra í líkamsvökva). Lyfið er hægt að nota við margar aðstæður, en ein algeng notkun er að leiðrétta sýru í blóði meðan á eða eftir hjartastopp eða hjartahjáveituaðgerð stendur yfir. Það er líka notað til að búa til stuðpúðalausnir eins og Pfizer hefur haldið því fram að það sé að nota efnið á þann hátt.
Er það í bóluefninu fyrir 5-11 ára börn?
Svarið er já.
- Í kynningarskjalinu sem FDA var gefið ráðgjafanefnd um bóluefni og tengdar líffræðilegar vörur í lok október er minnst á trómetamín.
- Að minnsta kosti ein „staðreyndaskoðun“ hefur villt um hvort innihaldsefnið sé innihaldið í Pfizer skotinu fyrir börn.
- „Í kynningarskjali sem Pfizer hefur sent til FDA er minnst á að trómetamín verði innifalið í sprautunum. segir.
- Sú fullyrðing um staðreyndaskoðun er röng.
Í kynningarskjalinu er reyndar minnst á það lyf og innlimun þess í formúlunni á blaðsíðu 14 undir kafla sem heitir „bóluefnissamsetning.“
Hér er kaflinn: https://apdillon.substack.com/p/what-is-tromethamine-and-why-is-it
Gerir lítið úr hugsanlegum aukaverknum öfugt við framleiðanda
- Þá gerði Rúna í viðtalinu lítið úr hugsanlegum aukaverkunum af bóluefninu og sagði m.a. að þær “verði bara „þessar klassísku,“ sem bólusettir kannist almennt við: „Verkur á stungustað, kuldahrollur, þreyta, höfuðverkur og eitthvað í þá áttina.“
- Þetta samræmist hins vegar ekki því sem fram kemur í upplýsingabæklingiframleiðandans Pfizer sem tiltekur hættuna á mun alvarlegri aukaverkunum eins og t.d. hjartavöðvabólgu og gollurshússbólgu.
Aðspurð um stöðu aukaverkana í Bandaríkjunum hjá þessum aldurshópi sagði Rúna:„Bandaríkin eru náttúrulega stærst, þar hafa verið flestir bólusettir í þessum hópi, það eru um sjö milljónir. Þar hafa verið tilkynntar 3.000 aukaverkanir, 97 prósent af þeim eru almennar. Þeir hafa fengið átta tilkynningar um hjartabólgur sem er náttúrulega alvarleg aukaverkun svo það er kannski það sem einna helst stendur upp úr“.
Rúna nefnir ekki hvaða hún hefur þessar upplýsingar, en miðað við að hún nefni átta tilkynningar um hjartabólgur má ætla að Rúna sé þarna að vísa til upplýsinga frá Sóttvarnarstofnun Bandaríkjanna (CDC) sem náðu fram til 10. desember sl. og birtar voru skömmu síðar. Þau gögn segja hins vegar allt aðra sögu en Rúna segir í viðtalinu en hún sagði ekki heldur frá yfirlýsingu Pfizer um ónægar rannsóknir á öryggi
- Það sem Rúna sagði ekki frá í viðtalinu vekur einnig upp spurningar um það hvort forstjóri Lyfjastofnunar hafi hagsmuni barnanna í fyrirrúmi þegar kemur að bóluefni Pfizer. Í skjali frá fundi sérfræðinga Matvæla- og lyfjastofnunar Bandaríkjanna (FDA) þann 26. október sl. kemur fram á bls. 11 að Pfizer hafi viðurkennt að fjöldi sjálfboðaliða í klínískum rannsóknum væri of lítill til að hægt væri að greina hættuna á hjartavöðvabólgu hjá börnum á aldrinum 5-12 ára.
Þrátt fyrir þessa yfirlýsingu Pfizer ákvað FDA í Bandaríkjunum að gefa út leyfi til neyðarnotkunar bóluefnisins fyrir börn á aldrinum 5 til 11 ára. Á grundvelli þessa og ákvörðunar Lyfjastofnunar Evrópu hefur Lyfjastofnun gefið út heimild til notkunar bóluefnisins, þrátt fyrir að framleiðandinn hafi lýst því yfir að óljóst sé hverjar afleiðingar af notkun þess verði bæði til skamms og langs tíma.
29. júlí 2021
-
Lyfjastofnun hefur nú borist 2442 tilkynningar um grunaðar aukaverkanir tengdum C19 bóluefnunum, þar af 151 alvarleg en alvarleg aukaverkun telst vera andlát, lífshættulegt ástand, innlögn á sjúkrahús o.fl.
-
Lyfjastofnun hafa borist fjórar tilkynningar um hjartavöðvabólgu í kjölfar bólusetningar gegn COVID-19. Ekki kemur fram í hvaða aldursflokki það er en í eldri frétt kemur fram að tvær væru í aldurshópnum 12-17 ára. Gollurhúsabólga er önnur aukaverkun sem tengist þessum lyfjum en þær upplýsingar fylgdu ekki með svarinu þó þessar tvær aukaverkanir séu nátengdar.
-
Lyfjastofnun hafa borist 24 tilkynningar vegna gruns um aukaverkun hjá einstaklingum á aldrinum 12-17 ára í kjölfar bólusetningar gegn COVID-19. Allar tilkynningarnar nema tvær varða Pfizer. Ein tilkynning varðaði AstraZeneca og ein tilkynning varðaði bóluefnið Janssen. Fimm tilkynninganna eru alvarlegar; tvær þeirra vörðuðu sjúkrahúsvist og þrjár tilkynningar voru metnar sem klínískt mikilvægar.
-
Öllum einstaklingum er batnað eða eru á batavegi nema einum.“
- Charles Hoffe, kanadískur læknir með meira en 30 ára reynslu, útskýrir í þessu viðtali hvers vegna og hvernig blóðtappar myndast eftir kóvid tilraunaefnin. Hann fjallar einnig um hvernig gaddapróteinið dreifist um líkamann í trilljónavís og veldur óafturkræfum skemmdum á hjarta, lungum og heila. Þetta er aðeins 8 mínútna bútur og allir sem eru enn að ákveða sig hvort þeir ætil að láta sprauta sig ættu að eyða tíma í að horfa á. Mæli ekki með að það fólk sem búið er að þiggja sprautu horfi á þetta, því það er of seint.
- Sem sagt, fimm alvarleg tilfelli hjá börnum 12-17 ára sem er hópur sem ekki er í hættu vegna Covid, tölfræðilega séð og einn hefur ekki náð bata. Sagt er að allir séu á batavegi nema einn. Það sem ég hef lesið um hjarta-og gollurhúsabólgu er að skaðinn sé varanlegur, þó þú jafnir“ þig. Þetta segir t.d. kanadíski læknirinn Charles Hoffe
-
Kristín Þormar:
- Heildarfjöldi tilkynninga á því tímabili frá því að bústin byrjuðu er orðinn 420, þar af 35 alvarlegar.
- Smá upprifjun á hvað alvarleg aukaverkun er:
- Alvarleg aukaverkun er aukaverkun eða óæskileg áhrif lyfs sem leiðir til dauða, lífshættulegs ástands, sjúkrahúsvistar eða lengingar á sjúkrahúsvist, veldur fötlun eða fæðingargalla hjá mönnum.
- Búið er að segja núna að 35 manneskjur séu látnar eftir þær, en það var falið í viðtali við forstjóra Lyfjastofnunar í síðustu viku.
- Áður var búið að segja frá 32 andlátum, en ég minnist ekki að hafa séð sérstakar tilkynningar um þessi 3 nýjustu í fjölmiðlunum frekar en öll hin.
- Það er greinilega meiri frétt að gamalmenni á níræðisaldri sem eru væntanlega tví- eða þrísprautuð deyi vegna veirunnar, að sögn.
- Þessi þöggun um þessar þegar tilkynntu 5.960 aukaverkanir lýsir ekkert öðru en einbeittum brotavilja þeirra sem búin eru að narra 90% þjóðarinnar í þessar sprautur – í fullkomnu samstarfi við fjölmiðlana, og nú er byrjað á litlu krökkunum!
- Hvað þarf til þess að fólk vakni, þurfa börn að veikjast og/eða deyja hér á landi eftir sprauturnar, rétt eins og er að gerast í öðrum löndum?
- https://www.utvarpsaga.is/thoggunin-um-aukaverkanirnar-og-andlatin-her-a-landi-eftir-sprauturnar-er-ekkert-annad-en-glaepsamleg
Metfjöldi tilkynntra alvarlegra aukaverkana á stuttu tímabili var birtur í dag, eða 4 yfir heLGI
Um höfund

- Sigurlaug Ragnarsdóttir
- ✞༺(((( Ⓒilla ℜągnąℜṧ )))༻♚༺ BA Classical Art Historian || MA Culture & Media || Tourism & Sales Management || Web Design || Photo & Videographer for Tourism Magasins ༻
Síðustu færslur
 PROTECT THE CHILDREN23. nóvember, 2024BARNAMÁLARÁÐSTEFNAN 2024
PROTECT THE CHILDREN23. nóvember, 2024BARNAMÁLARÁÐSTEFNAN 2024 MANNRÉTTINDI19. nóvember, 2024MENNTASPJALL VALGERÐAR SNÆLAND JÓNSDÓTTUR
MANNRÉTTINDI19. nóvember, 2024MENNTASPJALL VALGERÐAR SNÆLAND JÓNSDÓTTUR Sigurlaug Ragnarsdóttir15. ágúst, 2024‘Really Chilling’: Five Countries to Test European Vaccination Card
Sigurlaug Ragnarsdóttir15. ágúst, 2024‘Really Chilling’: Five Countries to Test European Vaccination Card MANNRÉTTINDI9. ágúst, 2024Lög um borgaralega handtöku voru felld úr gildi árið 2008
MANNRÉTTINDI9. ágúst, 2024Lög um borgaralega handtöku voru felld úr gildi árið 2008